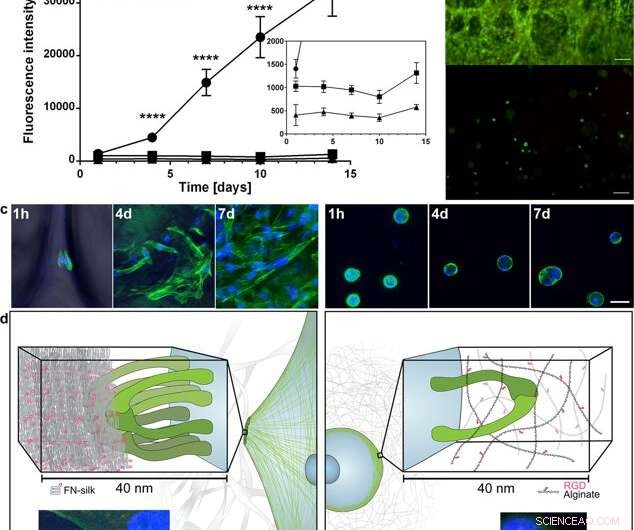
Difusión y expansión de las células dentro de la seda FN en comparación con cuando se encapsulan en un hidrogel acoplado a RGD. (a) Gráfico representativo (media y desviación estándar) del ensayo de viabilidad de Alamar Blue que muestra la actividad metabólica de los fibroblastos (HDF) dentro de la espuma de seda FN (círculo), un hidrogel de alginato de muy baja viscosidad (VLVG) acoplado con RGD (cuadrado), y un hidrogel de alginato de viscosidad media (MVG) acoplado con RGD (triángulo) durante dos semanas de cultivo. Insertar muestra una vista ampliada de las intensidades más bajas. Estadísticas (prueba t de Student en cada punto de tiempo):**** indica p <0,0001 (n =12) (b) Tinción representativa viva (verde) y muerta (rojo) de células madre mesenquimales humanas (HMSC) en FN- espuma de seda (superior) y alginato acoplado a RGD VLVG (inferior) el día 14. Barras de escala =100 µm. (c) Exploraciones confocales de HMSC integradas en espuma de seda FN (panel izquierdo), y MVG de hidrogel de alginato acoplado a RGD (panel derecho) después de 1 h, 4 días y 7 días. Los filamentos de actina se visualizan mediante tinción con faloidina (verde) y los núcleos celulares se tiñen con DAPI (azul). Barras de escala =20 µm. (d) Descripción esquemática de la hipótesis de la razón detrás de la diferencia observada en las interacciones entre las células y la seda (izquierda) frente a los hidrogeles de alginato acoplados a RGD (derecha). Varios pares de integrinas (verde) pueden adherirse y juntarse a las microfibras de seda, formando adherencias focales en el borde de los filamentos de actina, permitiendo que las células se propaguen y proliferen. En el hidrogel de alginato, un solo par de integrinas (verde) puede unirse al motivo RGD acoplado, pero las delgadas cadenas de alginato restringen la acumulación subsiguiente en adherencias focales. Los insertos muestran ejemplos de una célula (fibroblasto) después de 3 h en espuma de seda FN (izquierda) y un hidrogel de alginato de baja viscosidad (VLVG) acoplado con RGD (derecha). Los filamentos de actina se visualizan mediante tinción con faloidina (verde), y se pueden ver adherencias focales donde esto se co-localiza con tinción para vinculina (rojo, marcado con una flecha). Los núcleos celulares se tiñen con DAPI (azul). Crédito:Informes científicos, doi:10.1038 / s41598-019-42541-y
Los tejidos biológicos se construyen cuando las células se anclan a sitios específicos en una red de microfibras 3-D en una matriz extracelular (ECM). Los científicos están interesados en recrear tejidos biológicos en el laboratorio utilizando ingeniería de tejidos e ingeniería genética bioinspiradas. para formar motivos ECM funcionales fusionados con proteínas de seda recombinantes. En condiciones fisiológicas adecuadas, Las proteínas de seda de bioingeniería y la seda de fibronectina (seda FN) pueden autoensamblarse en redes de microfibras que imitan la ECM nativa.
En un estudio reciente, Ulrika Johansson, Mona Widhe y colaboradores de los departamentos interdisciplinarios de Biotecnología, Química de Biomateriales, and Immunology en Suecia desarrolló un método para incluir células de mamíferos en una solución de seda antes de ensamblar la seda en construcciones, para formar microfibras similares a tejidos uniformes integradas en las células. Las construcciones de armazón 3-D resultantes mostraron una proliferación celular mejorada (crecimiento) y una extensión celular homogénea en comparación con las células encapsuladas en hidrogel. Los resultados del estudio ahora se publican en Informes científicos .
Los científicos confirmaron la unión celular en las construcciones de fibronectina-seda (FN-Silk) en el trabajo al observar la actina filamentosa y al definir los puntos focales de adhesión de los adheridos, células alargadas. Mantuvieron la viabilidad celular durante 90 días en las superficies de células FN / seda y mostraron escalabilidad del método a cultivos de células 3-D de tamaño macro. Los haces de microfibras de seda con células encapsuladas mantuvieron la fuerza biomecánica y la extensibilidad de manera muy similar a las paredes arteriales humanas.
El protocolo desarrollado por Johansson y Widhe et al. también permitió que las células madre se diferenciaran dentro de las construcciones 3-D para ayudar al crecimiento de diversos co-cultivos celulares. Demostraron que las células endoteliales podrían incluirse en los materiales bioinspirados para formar estructuras similares a vasos en todas las construcciones de tejido. Los científicos prevén el uso de una red similar a ECM como base para futuros esfuerzos para diseñar tejidos biológicos funcionales en el laboratorio.
El cultivo de células de mamíferos in vitro es una técnica experimental indispensable en la investigación básica y las aplicaciones industriales. aunque el proceso existente se basa en superficies de vidrio o plástico duro 2-D para mayor comodidad, lo que perjudica la respuesta biológica nativa. Dado que las células biológicas están naturalmente acostumbradas a recibir señales del entorno 3-D, Los ingenieros de tejidos han creado nuevas estrategias experimentales utilizando cultivos de células 3-D. Las condiciones experimentales mantuvieron la adhesión celular, proliferación y diferenciación para recrear y mantener el metabolismo y la funcionalidad celular en el laboratorio.
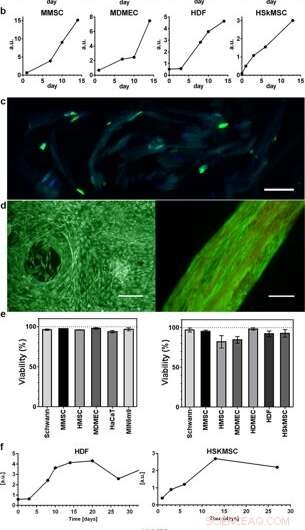
Proliferación y viabilidad de células integradas en seda 3D. Los gráficos representativos del ensayo de viabilidad del azul de Alamar muestran un aumento de la actividad metabólica durante las primeras 2 semanas dentro de (a) espuma (N =3–4, n =3-7), y (b) fibras (N =1–9, n =2-13), que refleja el crecimiento de los diversos tipos de células integradas (HaCaT; línea celular de queratinocitos humanos, HDF; fibroblastos dérmicos humanos, MDMEC; células endoteliales microvasculares dérmicas de ratón, MIN6m9; línea de células β pancreáticas de ratón secretoras de insulina). (c) La división celular ocurre profundamente dentro de la seda 3D. Crioección de una fibra con fibroblastos integrados (HDF) fijada el día 11 y teñida con FITC-anti BrdU para ADN recién sintetizado (verde) y DAPI (azul). La seda muestra una autofluorescencia tenue en el rango azul / verde. (d) Tinción representativa viva (verde) y muerta (rojo) de células madre mesenquimales de ratón (MMSC) en espuma (izquierda) y HDF en fibra (derecha) en el día 14. La fibra muestra una autofluorescencia tenue en el rango rojo. Barras de escala =100 µm. (e) Viabilidad (%, media y desviación estándar) después de 14 días de cultivo de diferentes tipos de células (ver Suplemento Tabla 1) en espuma (gráfico de la izquierda), y en fibras (gráfico de la derecha) (N =1-3, n =4). (f) Cultivos prolongados de células integradas en fibras mantuvieron la actividad metabólica (azul Alamar) durante todo el período de estudio (hasta 97 días). Crédito:Informes científicos, doi:10.1038 / s41598-019-42541-y
Previamente, Johansson y Widhe et al. había desarrollado un proceso escalable para diseñar la proteína recombinante de seda de araña conocida como 4RepCT para cultivo celular bioinspirado en el laboratorio, que se autoensamblaron en microfibras biodegradables y biocompatibles en agua, tampones fisiológicos a temperatura ambiente. Funcionalizaron la nueva construcción utilizando un motivo de adhesión celular de fibronectina (FN) para formar el material de seda FN y promover la unión celular firme. Aunque las células proliferaron a lo largo de las superficies del nuevo material, se quedaron solos en la superficie, incapaz de proliferar en las construcciones para imitar adecuadamente las propiedades de tipo tejido in vitro. En el presente trabajo, Por lo tanto, los científicos desarrollaron un nuevo método, para incrustar de manera eficiente las células en el material de seda durante el ensamblaje de la seda FN para un cultivo de células 3-D encapsulado y viable que imita adecuadamente la matriz extracelular in vitro.
Construcciones de seda incrustadas en células de ingeniería de tejidos en el laboratorio
Durante los experimentos, Johansson y Widhe et al., primero agregó una gota de células madre dispersas (células madre mesenquimales de ratón, MMSC) a la solución de proteína de seda FN antes del ensamblaje de la solución. Después de la incubación, la red recién formada permaneció estable en los medios de cultivo y el número de células encapsuladas aumentó en las construcciones durante el período de cultivo. Después de tres días, las células se extienden por todas las dimensiones de la espuma, que los científicos observaron utilizando microscopía de contraste de interferencia diferencial (DIC).
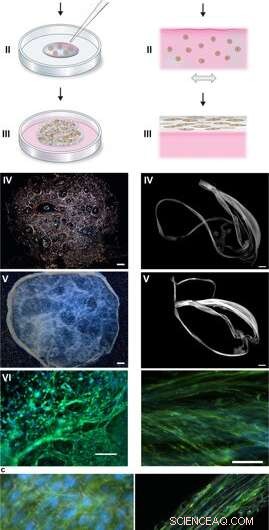
Ensamblaje de seda para integrar células en una red 3D de microfibras. (a) Descripción esquemática de la formación de espuma de seda con células arraigadas. Las células suspendidas en medio de cultivo (rosa) se añaden a una gota definida de solución de proteína de seda FN (azul) colocada en el medio de un pocillo de cultivo no tratado (I). Las burbujas de aire se introducen rápidamente (5 a 10 segundos) a través de una punta de pipeta (II), para dar lugar a una espuma 3D con células. Después de 30 minutos en la incubadora de células, se agrega medio de cultivo adicional para cubrir la espuma completamente (III). Día 1 después de la formulación, la espuma de seda con células parece casi transparente, aunque albergando algunas burbujas de aire restantes (que desaparecen con el tiempo) (IV). Después de 2 semanas de cultivo, la espuma con células integradas muestra un aspecto más denso y blanco (V). Ya en el día 3 la espuma está llena de células bien diseminadas (aquí se muestran las células madre mesenquimales de ratón (MMSC)) (VI). Los filamentos de actina se visualizan mediante faloidina (verde) y los núcleos celulares mediante tinción DAPI (azul). Barra de escala IV-V =1 mm, VI =100 µm. (b) Descripción esquemática de fibras de seda formadas con células integradas. Las células suspendidas en medio (rosa) se agregan a la solución de proteína de seda FN (azul) (I). Durante la inclinación uniaxial repetida suave durante 1-3 horas (II), las proteínas de la seda se ensamblan en la interfaz aire-líquido en un paquete macroscópico de microfibras con células incorporadas (III). Las fibras de seda con células se recuperan fácilmente (IV) y se pueden colocar en un pozo para su posterior cultivo. por lo que el grosor aumenta a lo largo de 2 semanas (V). En el día 3, las células alineadas (aquí MMSC) se encuentran dispersas integradas en el haz de fibras (VI). Los filamentos de actina se visualizan mediante faloidina (verde) y los núcleos celulares mediante tinción DAPI (azul). Barra de escala IV-V =1 mm, VI =100 µm. (c) Micrografías de contraste de interferencia diferencial (DIC) de las microfibras de seda (blancas) en una fibra (izquierda) y una espuma (derecha) con células integradas (MMSC). Los filamentos de actina se visualizan mediante faloidina (verde) y los núcleos celulares mediante tinción DAPI (azul). Barra de escala =50 µm (izquierda) y 100 µm (derecha). Crédito:Informes científicos, doi:10.1038 / s41598-019-42541-y
Dirigieron la alineación celular para formar una red tridimensional aleatoria de microfibras que imitaba con éxito los tejidos biológicos al formar un paquete macroscópico de microfibras durante la línea de tiempo del cultivo celular. seguido de un examen de la proporción de células a ECM. Los científicos variaron la ECM a la composición celular para imitar o igualar una variedad de tipos de tejidos, incluidos los tejidos del hígado con células escasas y de alta densidad. Por lo tanto, el método también es adecuado para cultivos celulares en 3D con cantidades diminutas de células.
Prueba de la viabilidad celular en los andamios de seda:estudios de citocompatibilidad
Los científicos utilizaron perfiles de crecimiento para mapear los diversos tipos de células incrustadas tanto en la espuma como en las fibras del ensamblaje de la seda. Observaron un aumento de la señal de la actividad metabólica para representar la proliferación celular en los andamios de seda 3-D y, con el tiempo, mostraron un aumento de la densidad celular en el andamio de seda celular más interno. Johansson y col. investigó la proliferación celular usando tinción BrdU, donde los resultados positivos demostraron una proliferación y una extensión celular más profundas en las fibras de seda para mantener la viabilidad celular después de 2 semanas de encapsulación, y durante períodos de cultivo celular a largo plazo que se extendieron de uno a tres meses.
Comparación de la citocompatibilidad de los biomateriales de seda frente a los de hidrogel
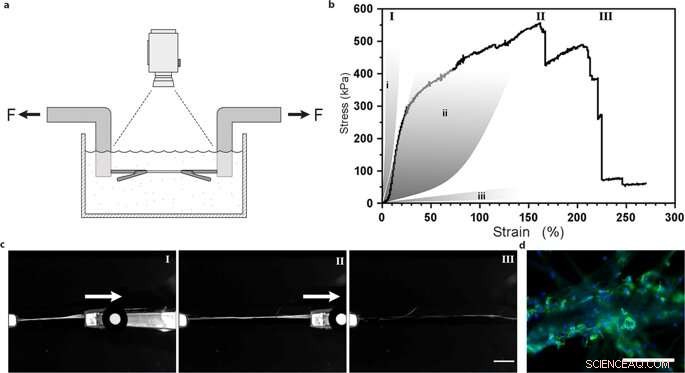
Ensayo de tracción uniaxial de fibras de seda con células madre mesenquimales integradas. (a) Ilustración de la configuración experimental para ensayos de tracción realizados en tampón PBS a 37 ° C con el fin de mantener células viables. (b) Curva de tensión versus deformación representativa de First Piola-Kirchhoff de una fibra de seda FN con células madre mesenquimales integradas (MMSC) sometidas a pruebas de tracción después de 14 días de cultivo. La curva de tensión-deformación ilustra una fase bastante lineal (y probablemente elástica) seguida de una fase de deformación plástica (irreversible) hasta que se alcanza la tensión máxima. y la fibra se rompe. Para comparacion, las áreas grises representan rangos de propiedades de deformación por tensión en tendones y ligamentos (i), paredes arteriales (ii), y tejido cerebral (iii). Los números romanos se refieren a las imágenes (c) tomadas durante la prueba de tracción, es decir, durante el inicio (I), extensión (II) y rotura (III) de las fibras. Barra de escala =5 mm. (d) Micrografías del punto de rotura de las fibras con MMSC después de la prueba de tracción. Los filamentos de actina se visualizan mediante tinción con faloidina (verde) y los núcleos celulares se tiñen con DAPI (azul). Barras de escala =200 µm. Crédito:Informes científicos, doi:10.1038 / s41598-019-42541-y
Sobre la base de los alentadores resultados preliminares, Los científicos llevaron a cabo experimentos paralelos para comparar el crecimiento celular en seda con el crecimiento celular en hidrogel para determinar la citocompatibilidad de los dos materiales. Eligieron el alginato para representar el hidrogel durante el cultivo celular y observaron diferencias entre el alginato y la seda. registrar la expansión de células claras en la seda, mientras que las células en el alginato permanecieron en un estado metabólico estable. Usando microscopía confocal, investigaron las razones de la diferencia observada en el crecimiento celular a nivel del microambiente. Los resultados mostraron una rápida adhesión celular (vista con células alargadas) en las construcciones de seda, mientras que las construcciones de alginato se contrajeron durante el cultivo celular, que puede haber estresado las células para desprenderse.
Estudios biomecánicos:caracterización de los nuevos materiales
Determinaron que la rigidez de la superficie del material era un componente crucial que afectaba el destino de las células. Para verificar esta observación, Johansson y col. probaron el comportamiento biomecánico de las construcciones de seda para asegurarse de que imitaban adecuadamente el tejido nativo. Realizaron pruebas de tracción en un búfer fisiológico para obtener los resultados, lo que demostró que las propiedades mecánicas de las células que contienen seda coincidían con las del tejido conectivo, como las paredes arteriales. Johansson y col. Pudieron demostrar una alta extensibilidad de las microfibras para indicar la transición de fuerza hacia y a través de las células adheridas al nuevo biomaterial, lo que confirma la unión celular adecuada.
Estudios de biofuncionalización:investigación de la biocompatibilidad superficial in vitro
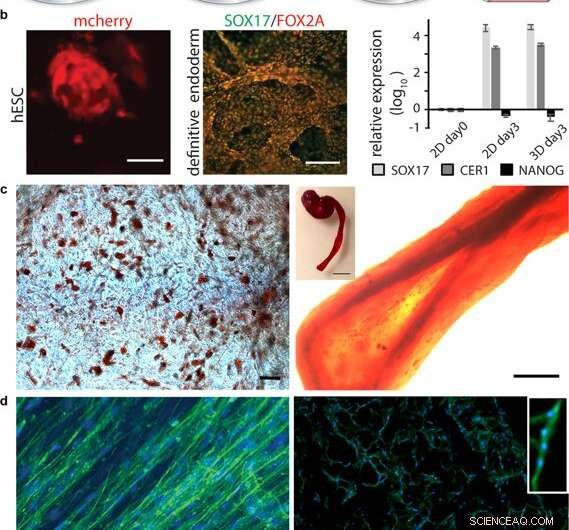
Diferenciación de células en seda 3D. (a) Después de la expansión inicial de las células madre integradas a la seda 3D, la diferenciación en varios tipos de tejidos puede desencadenarse mediante la adición de factores apropiados. (b) Diferenciación de células madre pluripotentes. Izquierda:células madre embrionarias humanas (hESC) visualizadas por detección de mCherry a las 48 h después de la integración celular en la espuma de seda FN. Barra de escala =50 µm. Medio:inmunotinción para marcadores endodérmicos SOX17 (verde) y FOX2A (rojo) después de 3 días de diferenciación. Barras de escala =200 µm. Derecha:expresión genética (SOX17, CER1, NANOG) de hESC en una espuma de seda FN en comparación con cultivo 2D, analizados por RT-qPCR en el día 3 de la inducción endodérmica. Las barras representan el cambio de veces medio ± desviación estándar (n =4). (c) Diferenciación de células madre adultas multipotentes. Izquierda:células madre mesenquimales humanas (HMSC) en espuma de seda FN diferenciadas en el linaje adipogénico que contiene lípidos, visualizado por tinción de aceite rojo (rojo) (N =2, n =4). Barra de escala =100 µm. Derecha:HMSC diferenciadas en el linaje osteogénico, sondeado con marcador osteogénico para el contenido de calcio (Alizarin Red S (rojo) en fibra de seda FN (derecha, barra de escala =200 µm), (N =2, n =4). El recuadro muestra una foto de una fibra completa (derecha), barra de escala =1 mm). (d) Diferenciación de células precursoras adultas. Izquierda:Después de 14 días en medios de diferenciación, Las células satélite del músculo esquelético (HSkMSC) dentro de una fibra de seda FN muestran filamentos de actina prominentes, como se visualiza mediante tinción con faloidina (verde). Derecha:diferenciación miogénica de células satélite del músculo esquelético (HSkMSC) visualizada mediante tinción con Desmin (verde). Núcleos teñidos con DAPI en azul. (N =9, n =4). Barras de escala =200 µm. En la esquina superior derecha se muestra un primer plano del área de un miotubo multinucleado. Crédito:Informes científicos, doi:10.1038 / s41598-019-42541-y
Después de establecer la estabilidad biomecánica, los científicos probaron si las células madre que crecían en los andamios de seda podían diferenciarse (madurar) en el mismo material. Para esto, utilizaron células madre embrionarias humanas pluripotentes y multipotentes en los ensayos de cultivo celular, seguido de la cuantificación de la expresión génica de marcadores biológicos de crecimiento celular; FOXA2 (genes metabólicos), SOX17 (genes para el desarrollo embrionario y la determinación del destino celular), CER1 (antagonistas de proteínas morfogenéticas óseas) y NANOG (proliferación de células madre embrionarias, pluripotencia y renovación). En los resultados, tanto SOX17 como CER1 mostraron una fuerte regulación al alza, mientras que el biomarcador de pluripotencia (NANOG) disminuyó debido a la madurez celular como resultado de la pérdida de pluripotencia.
Los científicos probaron la biofuncionalización de la superficie para diversos tipos de células, incluidas las células satélite del músculo esquelético humano (HSkMSC) y las células madre mesenquimales humanas derivadas de la médula ósea (hMSC). Después de la expansión celular en las construcciones, los científicos podrían dirigir el destino de las hMSC en linajes de células adipogénicas u osteogénicas. Adicionalmente, después de dos semanas de cultivo celular, Johansson y col. mostró diferenciación miogénica de las HSkMSC para formar filamentos de actina prominentes, y expresan el marcador desmina específico del músculo, para verificar la maduración de miotubos in vitro.
Ingeniería de recipientes biológicos en el laboratorio
Luego, los científicos combinaron células endoteliales en la red vascular tridimensional para formar tejido conectivo que imitaba la organización celular inherente de los microvasos en el laboratorio. Siguieron el mismo protocolo utilizando ensamblaje de seda con integración celular y agregaron una fracción de células endoteliales para diseñar el tejido conectivo. En dos semanas, observaron que las células se juntan y forman brotes ramificados de milímetro de largo y estructuras en forma de vasos con anillos prominentes de células endoteliales en las fibras de seda. Los científicos podrían aumentar el tamaño de las construcciones a escala y determinar la alineación y agregación de diversos tipos de células.
De este modo, Johansson y Widhe et al. demostró una nueva estrategia y desarrolló un protocolo para encajar en células funcionales dentro de redes 3-D que imitaban la arquitectura fibrosa de la matriz extracelular nativa (ECM). Para mediar en el experimento, utilizaron proteínas de seda recombinantes de autoensamblaje y demostraron que se podían incrustar una variedad de células en las construcciones tridimensionales. La configuración y el protocolo son simples y rentables, a diferencia de la impresión 3D, el proceso es frugal y práctico, sin maquinaria cara. Los científicos tienen como objetivo optimizar y estandarizar este protocolo para desarrollar biocompatibles, materiales de seda avanzados en ingeniería de tejidos. El trabajo experimental tendrá una amplia gama de aplicaciones en la ciencia de los materiales como modelos in vitro en miniatura para el desarrollo de fármacos y como construcciones de tejidos más grandes mediante bioingeniería en la medicina regenerativa.
© 2019 Science X Network