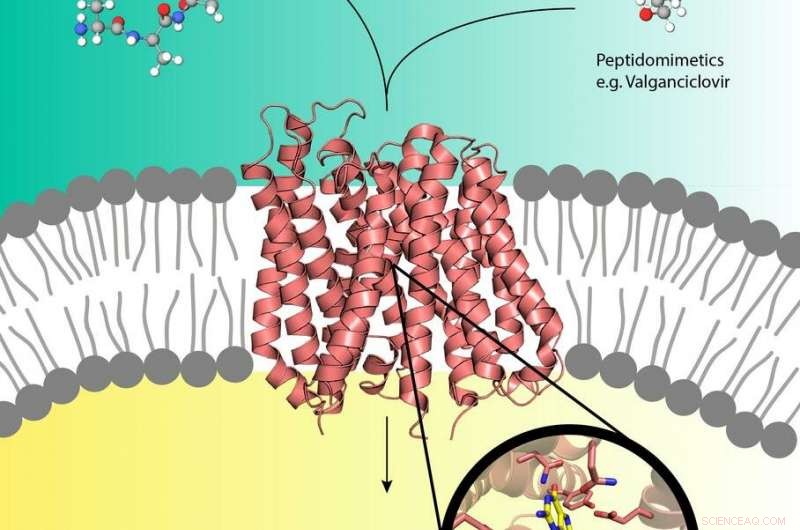
Los profármacos como el valganciclovir (arriba a la derecha) pueden usar el transportador de péptidos (centro) en la membrana celular que generalmente transporta los péptidos de nutrientes (arriba a la izquierda) a la célula. Crédito:EMBL, Yonca Ural-Blimke
Los experimentos en la fuente de rayos X de DESY, PETRA III, han revelado la primera estructura de una proteína transportadora biológica cargada con un profármaco. Los profármacos son medicamentos inactivos que se metabolizan en un activo, forma funcional dentro del cuerpo. Pueden secuestrar las proteínas transportadoras de nutrientes humanas PepT1 o PepT2 que se encuentran en la membrana celular y generalmente canalizan péptidos derivados de alimentos digeridos hacia las células. De esta manera, los pro-drogas pueden viajar directamente a la celda, acelerando la absorción de la droga. Si bien el concepto pro-drogas es muy efectivo, poco se sabe a nivel molecular sobre la estructura de los transportadores de péptidos y cómo reconocen, unir y transportar profármacos. Los grupos de Christian Loew y Jan Kosinski del Laboratorio Europeo de Biología Molecular (EMBL) que trabajan en el Centro de Biología de Sistemas Estructurales (CSSB) en el campus de DESY en Hamburgo están ahora un paso más cerca de comprender esto.
Los científicos determinaron la primera estructura cristalina de alta resolución de un transportador de péptidos en complejo con el profármaco valganciclovir farmacológicamente relevante; un medicamento que combate ciertas infecciones virales. Sus resultados, publicado en el Revista de la Sociedad Química Estadounidense , podría ayudar en el diseño de profármacos con mejores tasas de absorción. CSSB es una cooperación de diez instituciones científicas, incluida DESY.
El transportador de péptidos bacterianos DtpA de Escherichia coli es un homólogo cercano del transportador PepT1 humano y, por lo tanto, los científicos lo eligieron como prototipo. La estructura espacial de una biomolécula se puede determinar cultivando pequeños cristales de muchas de las mismas biomoléculas e iluminándolos con rayos X. Los cristales difractan los rayos X de una manera que está relacionada con su estructura interna. Esto significa, del patrón de difracción, la estructura interna del cristal se puede calcular, revelando la estructura atómica de sus componentes, las biomoléculas.
El cultivo de cristales de alta calidad a partir de biomoléculas puede resultar muy complicado. Para producir cristales bien difractantes de DtpA, Loew se asoció con el grupo de Jan Steyaert de la Vrije Universiteit en Bruselas para generar nanocuerpos específicos de DtpA. Los nanocuerpos son fragmentos de anticuerpos de dominio único específicos. “Aumentan la estabilidad de las proteínas de las membranas como la DtpA, lo que nos permite generar cristales de alta calidad, "explica Loew.
Luego, el grupo de Loew llevó a cabo los experimentos de cristalización de DtpA en complejo con un nanocuerpo y una molécula de profármaco en la instalación de preparación y caracterización de muestras (SPC) y analizó los cristales obtenidos en las líneas de luz P13 y P14 que forman parte de X- de DESY. fuente de luz de rayos PETRA III y operada por t EMBL. Los científicos pudieron determinar una estructura de resolución de 2,65 Ångstrom (0,265 nanómetros) de DtpA unida con el profármaco valganciclovir que reveló un modo de unión inesperado. "La orientación del profármaco en el bolsillo de unión se invierte 180 grados en relación con las predicciones anteriores, "explica Loew." También descubrimos que DtpA preferiblemente se une y probablemente transporta tripéptidos sobre dipéptidos ".
El grupo Kosinski construyó un modelo estructural de alta calidad del transportador PepT1 humano en complejo con valganciclovir utilizando la estructura cristalina de DtpA como guía. "El modelo muestra que es muy probable que PepT1 humano se una al fármaco de la misma manera que DtpA y señala los grupos de aminoácidos exactos responsables de la unión, "aclara Kosinski. Por lo tanto, Los conocimientos generados por este modelo de PepT1 pueden facilitar el desarrollo de nuevos profármacos con tasas de absorción mejoradas. Tales mejoras no solo reducirían la dosis farmacológicamente eficaz, sino que también podrían reducir los efectos secundarios negativos experimentados por los pacientes.