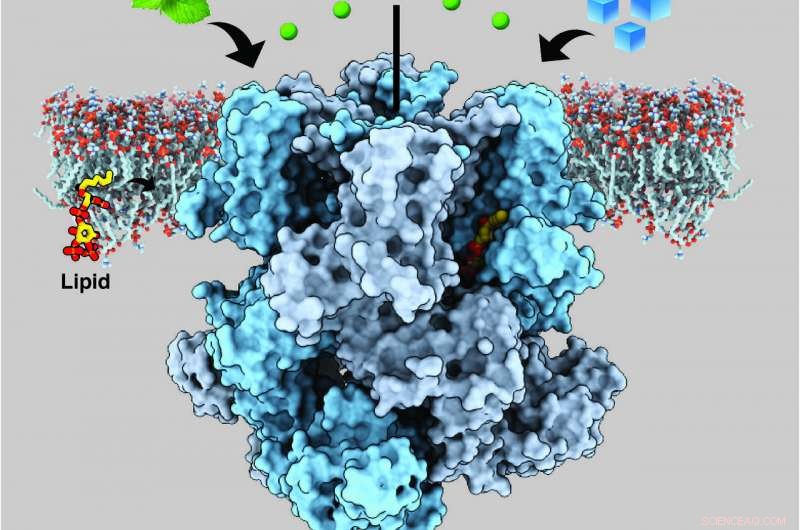
Un canal iónico en las células nerviosas humanas llamado miembro 8 de melastatina potencial de receptor transitorio (TRPM8) detecta tanto la frialdad como el mentol, transmitiendo sensaciones refrescantes mediante la liberación de calcio (esferas verdes). Crédito:Ying Yin, Universidad de Duke
Las personas son excelentes para detectar temperaturas frías y también la sensación de frío inducida por sustancias naturales como el mentol, que es común en los remedios que se utilizan para calmar los músculos doloridos. Pero no ha quedado del todo claro cómo lo hacemos.
Hace un año, un grupo de investigadores dirigido por Seok-Yong Lee, Profesor asociado de bioquímica en la Facultad de Medicina de la Universidad de Duke, descubrió la arquitectura de la proteína sensible al frío humana y animal, un canal de iones llamado TRPM8, lo que les dio una idea de su función, pero también planteó más preguntas.
Ahora, El equipo de Lee ha determinado la estructura que asume TRPM8 cuando está unido al mentol y a otro agente refrescante sintético llamado icilina. Los resultados, que aparecerá en Ciencias el 8 de febrero podría allanar el camino hacia nuevos tratamientos para el dolor crónico y la migraña y ayudar a los pacientes que sufren de extrema sensibilidad al frío.
En un intento por comprender mejor TRPM8, Lee y sus colegas utilizaron una técnica llamada microscopía crioelectrónica (cryo_EM), que es nuevo para Duke.
La estrategia consiste en purificar la proteína de las células, flash congelándolo, y luego rebotando electrones de la muestra incrustada en hielo en una máquina gigante llamada Titan Krios. El crio-EM hizo una composición de imágenes de más de un millón de partículas de proteína en varias orientaciones y luego calculó una estructura tridimensional de alta resolución para TRPM8.
La parte más complicada según Lee, estaba encontrando una versión de la proteína que fuera lo suficientemente estable como para visualizar su estructura. El mayor éxito que tuvieron fue con los canales TRPM8 de un pequeño, pájaro blanco y negro llamado papamoscas de collar, que tiene canales similares al TRPM8 humano. Generaron y aislaron la proteína en el laboratorio, luego se mezcla con mentol o icilina y PIP2 (fosfatidilinositol 4, 5-bisfosfato), una molécula lipídica que envía señales dentro de las células y que se ha demostrado previamente que es necesaria para que TRPM8 detecte correctamente tanto el mentol como la icilina.
El equipo descubrió que el lugar en TRPM8 donde se unen el mentol y la icilina es adyacente al sitio de unión para PIP2. La proximidad de estos lugares de unión sugiere que PIP2 y los agentes refrigerantes probablemente cooperen para controlar los cambios estructurales en TRPM8 que le permiten señalar la detección del frío mediante el envío de señales eléctricas al cerebro. pero esa sigue siendo una pregunta abierta.
"Descubrimos la unión del mentol a TRPM8, y tenemos alguna pista sobre cómo se abre este canal, pero todavía no entendemos por completo cómo se acopla esta unión de mentol a la apertura del canal, "dijo Lee, agregando que su grupo planea enfocarse en cómo se abre el canal en el futuro.
Sin embargo, él dijo, Este y los pasos futuros para obtener una mayor comprensión de cómo funciona TRPM8 son importantes porque la proteína también es el objetivo de los analgésicos. incluidos los remedios tópicos que contienen mentol. Si bien su activación generalmente conduce al alivio del dolor, en algunos casos, como la alodinia por frío, donde sensaciones menores como unas gotas de agua fría en la piel pueden causar dolor, apagar el canal podría tener beneficios.