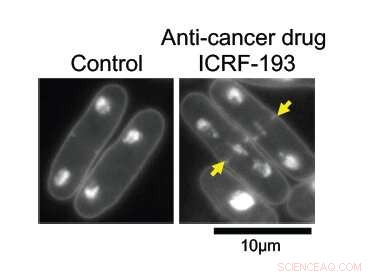
Con ADN topoisomerasa II (topo II) intacto, El ADN en las células de levadura de fisión se replica normalmente y se divide uniformemente entre dos células hijas (izquierda). Cuando está bajo los efectos del fármaco anticanceroso ICRF-193, el ADN se enreda en el centro de la célula madre, impidiendo su división limpia. Crédito:Universidad de Posgrado del Instituto de Ciencia y Tecnología de Okinawa
Al igual que los cordones de los zapatos o los collares colgantes, Las hebras de ADN pueden enredarse en nudos rebeldes. Las enzimas especializadas mantienen el ADN organizado cuando las células se dividen, para que las células se dividan suavemente y no se atasquen. Pero en las células tumorales, este dispositivo a prueba de fallos permite que el cáncer se propague. Ahora, Los científicos de la Universidad de Graduados del Instituto de Ciencia y Tecnología de Okinawa (OIST) han aprendido cómo funciona este mecanismo en la levadura de fisión y cómo podría debilitarse en el cáncer humano.
El estudio, publicado en línea el 11 de enero de 2019 por el Revista de química biológica , se centra en un objetivo bien establecido de la terapia del cáncer:ADN topoisomerasa II, o topo II para abreviar. Topo II regula la topología del ADN, gestionar la estructura cambiante de las hebras a lo largo del tiempo. Las células cancerosas muestran una actividad mejorada de topo II, que a su vez estimula el crecimiento del tumor. Los medicamentos contra el cáncer Topo II suprimen la función de la enzima, evitar que las células tumorales se repliquen y obstaculizar la propagación del cáncer.
Pero los fármacos topo II existentes han tenido un éxito limitado:los científicos necesitan saber más sobre el mecanismo básico antes de poder mitigarlo eficazmente.
"Muchos investigadores están trabajando en topo II, pero utilizan principalmente células humanas o eucariotas superiores, "dijo el Dr. Norihiko Nakazawa, primer autor del estudio y científico del personal de la Unidad Celular G0 de OIST, dirigido por el Prof. Mitsuhiro Yanagida. La Unidad optó por estudiar el topo II en levaduras de fisión porque sus mecanismos de división celular se conservan en gran medida en humanos. él dijo, además de ser rápido y fácil de manipular.
ADN topoisomerasa II (topo II), un regulador maestro del metabolismo del ADN para la proliferación celular, es un objetivo crítico para la terapia contra el cáncer. Crédito:Universidad de Posgrado del Instituto de Ciencia y Tecnología de Okinawa
"Podemos capturar rápidamente la reacción de topo II en la levadura, luego pasa a estudiarlo en células humanas, ", dijo Nakazawa." Nuestro trabajo muestra que la levadura es un buen modelo para detectar fármacos topo II y sería un método rápido para utilizar en aplicaciones clínicas ".
Aumento de la eficacia de los medicamentos contra el cáncer
Los investigadores tenían como objetivo aprender cómo funciona el topo II a nivel molecular. A mayores aumentos, sus efectos son obvios; las células con la enzima intacta se dividen normalmente, con la mitad de su material genético replicado a cada lado de la división. Sin topo II, el ADN permanece enredado en el centro de la célula madre, impidiendo su correcta división en dos células hijas.
Investigaciones anteriores sugieren que el topo II se basa en la fosforilación:la adición de un grupo fosfato en lugares precisos de su estructura. En levadura de fisión y células humanas, la enzima caseína quinasa II, también conocido como CKII, interviene para fosforilar regiones específicas de topo II. En este trabajo, Nakazawa identificó estas regiones y descubrió que algunas permanecían fosforiladas durante todo el ciclo celular. Este intercambio químico constante impulsó la actividad en una región de topo II conocida como el "dominio ATPasa". Aunque los investigadores observaron la mejora, en primer lugar, no pudieron decir cómo alteró realmente la función del topo II.
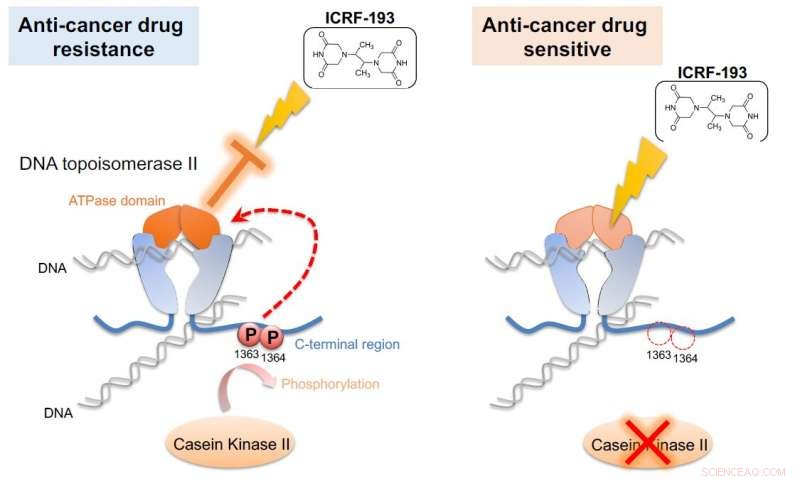
La caseína quinasa II (CKII) fosforila la ADN topoisomerasa II (topo II), activando así el dominio ATPasa de la enzima (izquierda). Esta activación cancela los efectos del fármaco anticanceroso ICRF-193. Si la actividad de CKII está atenuada (derecha), se rescata la eficacia de ICRF-193. La Unidad de Células G0 demostró este mecanismo en levadura de fisión, un modelo simple que podría usarse para la detección de medicamentos contra el cáncer. Crédito:Universidad de Posgrado del Instituto de Ciencia y Tecnología de Okinawa
Los científicos resolvieron el rompecabezas añadiendo un fármaco topo II a la mezcla. El fármaco ICRF-193 actúa inhibiendo la actividad ATPasa de topo II, que atrapa eficazmente el ADN en una configuración ajustada para que no pueda realizar reacciones enzimáticas. Pero en presencia de CKII, que aumenta la actividad de la ATPasa, la droga se vuelve ineficaz.
"Esta mejora [del dominio de la ATPasa] rompió el efecto del fármaco contra el cáncer, "dijo Nakazawa." Si bloqueamos la fosforilación, esta activación no ocurre y el fármaco sigue siendo eficaz ".
Base potencial para nuevas terapias
La evidencia sugiere que la topo II y la CKII interactúan en las células humanas tal como lo hacen en la levadura de fisión. Las células cancerosas expresan niveles más altos de topo II y CKII que los tejidos normales, y ambas enzimas se han asociado con una proliferación celular anormal. Ahora que los científicos comprenden el mecanismo subyacente de la levadura, pueden aplicar ese conocimiento en estudios futuros en células cancerosas humanas. Algún día, la investigación puede conducir a nuevos tratamientos contra el cáncer.
"Si inhibimos CKII y topo II, podría ser una forma muy eficaz de inhibir la división de las células cancerosas, ", dijo Nakazawa." Este efecto aditivo podría ser muy poderoso en la terapia del cáncer ".