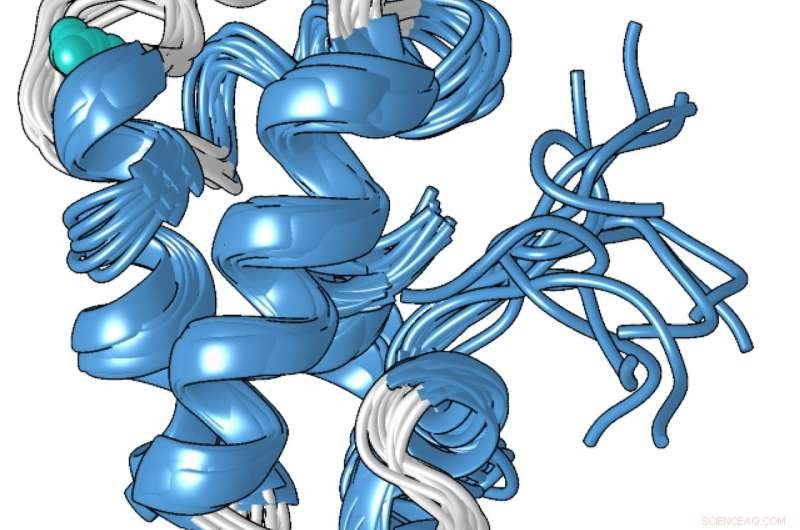
Un modelo estructural de la forma compacta unida a metal de la proteína lanmodulina, que es 100 millones de veces mejor para unirse a los lantánidos, los metales de tierras raras utilizados en los teléfonos inteligentes y otras tecnologías, que a otros metales como el calcio. Crédito:Penn State
Una proteína recién descubierta podría ayudar a detectar, objetivo, y recopilar del medio ambiente los metales de tierras raras que se utilizan en los teléfonos inteligentes. Dos nuevos estudios realizados por investigadores de Penn State describen la proteína, que es 100 millones de veces mejor para unirse a los lantánidos, los metales de tierras raras que se usan en los teléfonos inteligentes y otras tecnologías, que a otros metales como el calcio. El primer estudio, que aparece en el Revista de la Sociedad Química Estadounidense , describe la proteína, y el segundo papel, que aparece en línea en la revista Bioquímica , describe su estructura única, que probablemente juega un papel en su notable selectividad por los lantánidos.
"Recientemente, Ha habido mucho interés en aumentar la accesibilidad de elementos de tierras raras como los lantánidos, que se utilizan en las pantallas y la electrónica de los teléfonos inteligentes, baterías de coches híbridos, láseres y otras tecnologías, "dijo Joseph Cotruvo Jr., profesor asistente y profesor de desarrollo profesional Louis Martarano de Química en Penn State y autor de ambos estudios. "Debido a que las propiedades físicas de los elementos de tierras raras son tan similares, puede ser difícil apuntar y recolectar uno en particular. Comprender cómo esta proteína se une a los lantánidos con una selectividad tan increíblemente alta podría revelar formas de detectar y atacar estos importantes metales ".
El equipo de investigación descubrió la proteína, al que llamaron lanmodulina, dentro de la bacteria Methylobacterium extorquens, que crece en las hojas de las plantas y en el suelo y juega un papel importante en la forma en que el carbono se mueve a través del medio ambiente. Las bacterias requieren lantánidos para el correcto funcionamiento de algunas de sus enzimas, incluyendo uno que ayuda a las bacterias a procesar el carbono, que se requiere para su crecimiento.
"Estas bacterias necesitan lantánidos y otros metales como el calcio para crecer, ", dijo Cotruvo." Necesitan una forma de obtener cada metal del medio ambiente y asegurarse de que cada uno vaya al lugar correcto dentro de la celda ". Parece que estas bacterias han desarrollado una forma única de atacar los lantánidos en el medio ambiente, donde son mucho menos abundantes que otros metales como el calcio ".
La estructura única de la proteína, que Cotruvo determinó en colaboración con el laboratorio de Scott Showalter, profesor asociado de química en Penn State, puede explicar por qué es 100 millones de veces mejor para unir los lantánidos que el calcio. En ausencia de metal, Cotruvo explicó, la proteína no está estructurada en su mayor parte, pero cuando el metal está presente, cambia la conformación en un compacto, estructura bien definida.
La nueva forma compacta contiene cuatro estructuras llamadas "manos EF". Las células humanas contienen muchas proteínas con manos EF, que participan en el uso del calcio para funciones como la activación de las neuronas y la contracción de los músculos. Estas proteínas también se unen a los lantánidos, aunque los lantánidos no son fisiológicamente relevantes en los seres humanos y las proteínas tienen sólo 10 o 100 veces más probabilidades de unirse a los lantánidos que de unirse al calcio. La estructura compacta de la proteína lanmodulina también contiene un aminoácido llamado prolina en una posición única en cada una de las manos EF. lo que puede contribuir a la selectividad de lantánidos de la proteína.
"El mecanismo de la selectividad de la lanmodulina por los lantánidos aún no está claro, pero creemos que se reduce al cambio estructural que se produce en presencia de metales, ", dijo Cotruvo." Este cambio estructural es importante para la función de la proteína; por ejemplo, Algunas interacciones proteína-proteína pueden ocurrir solo cuando la proteína está en su forma compacta. Se requiere una cantidad muy pequeña de lantánidos para inducir el cambio conformacional, pero se necesitaría mucho más calcio, más de lo que las bacterias pueden tener, para inducir realmente el cambio. Esto ayudaría a asegurar la selectividad de los lantánidos dentro de las células ".
Comprender cómo la proteína es tan selectiva puede proporcionar información para la recolección de lantánidos con fines industriales. incluida la extracción de corrientes de desechos mineros.
"Procesar estas corrientes para separar los elementos de tierras raras de otros metales de manera económica es un desafío, "dijo Cotruvo, "tanto por la escasa abundancia de las tierras raras como por su insolubilidad, requiriendo grandes cantidades de ácido para mantenerlos en solución. Bajar el pH normalmente reduce la afinidad hacia los metales, pero creemos que esta proteína comienza con una afinidad tan alta que podría ayudar a superar estos desafíos. Actualmente estamos investigando esta posibilidad."
Además de explorar el mecanismo de selectividad de la proteína y la función de los aminoácidos ubicados de forma única, el equipo de investigación también está explorando la afinidad de la proteína por otros metales, porque los lantánidos se encuentran a menudo en presencia de otros metales, incluyendo hierro, manganeso, y aluminio, que ocurren en mayor abundancia.
"También estamos muy interesados en la función biológica de la proteína, ", dijo Cotruvo." Pero en última instancia, esperamos que la comprensión de la proteína conduzca a formas más respetuosas con el medio ambiente de adquirir metales de tierras raras del medio ambiente ".