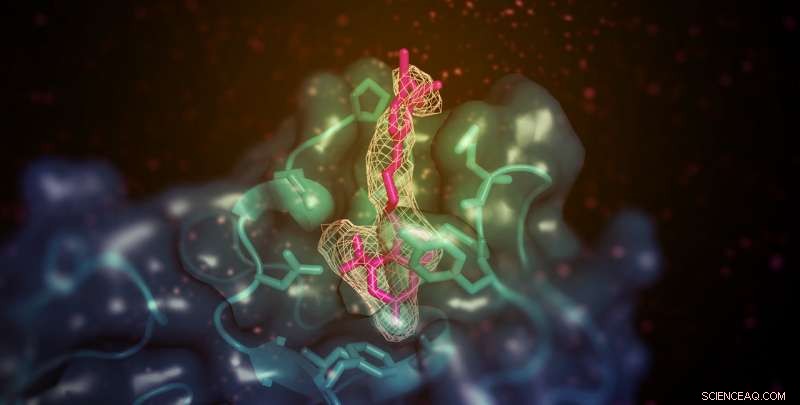
Una molécula pequeña (que se muestra aquí en rosa) con la capacidad de aumentar el colesterol "bueno" (HDL) en modelos animales se une al dominio de unión a la membrana de la lecitina:colesterol aciltransferasa (LCAT; mostrado en verde azulado). El sitio está alejado del sitio activo de la enzima, pero de alguna manera permite la transferencia de sustratos lipídicos de HDL. Crédito:Kelly Manthei y Stephanie King
Los científicos han determinado la estructura de la forma activada de una enzima que ayuda a devolver el exceso de colesterol al hígado. un estudio en eLife informes.
La investigación revela cómo una sustancia química similar a un fármaco estimula la acción de la enzima lecitina:colesterol aciltransferasa (LCAT). También sugiere que los medicamentos futuros que usen el mismo mecanismo podrían usarse para restaurar la función LCAT en personas con deficiencia familiar de LCAT (FLD), una rara enfermedad hereditaria que los pone en riesgo de problemas oculares, anemia e insuficiencia renal.
LCAT ayuda a las lipoproteínas de alta densidad (HDL), conocidas como colesterol "bueno", a eliminar el colesterol de la sangre al convertir el lípido en una forma más fácil de empaquetar y transportar. Hay más de 90 mutaciones conocidas en LCAT, que puede causar una pérdida parcial de actividad (conocida como 'enfermedad del ojo de pez') o una pérdida total (FLD). Por lo tanto, impulsar la actividad de LCAT podría ser beneficioso en el tratamiento de personas con enfermedad coronaria y deficiencias de LCAT, pero los mecanismos por los cuales se puede activar son poco conocidos.
"En este estudio, Usamos biología estructural para comprender cómo un activador LCAT patentado se une a LCAT y cómo promueve el transporte de colesterol. "dice la autora principal Kelly Manthei, becario postdoctoral en el Instituto de Ciencias de la Vida de la Universidad de Michigan, NOSOTROS. "También preguntamos si el compuesto podría ayudar a recuperar la actividad de las enzimas LCAT que comúnmente han observado mutaciones en FLD".
El equipo utilizó cristalografía de rayos X para observar la enzima LCAT estabilizada en su estado activo con dos sustancias químicas diferentes:la molécula activadora, y un segundo compuesto que imita un sustrato unido a la enzima. Los dos productos químicos tuvieron más efecto sobre la proteína cuando se presentaron juntos que cuando se presentaron por separado. lo que sugirió que se unen a la enzima en diferentes lugares.
Un análisis adicional encontró que la molécula activadora, a diferencia de otros activadores LCAT conocidos, se une a una región cercana a donde se adhiere el HDL. Sin embargo, el activador no ayudó a LCAT a unirse al HDL de manera más efectiva, lo que llevó al equipo a especular que, en cambio, ayuda a transferir colesterol y lípidos al centro catalítico de la enzima, para que pueda convertirlo en carga para su transporte en HDL.
Habiendo establecido este modo de acción, los investigadores probaron si esta molécula podría ayudar a recuperar la función de transporte de colesterol de una enzima LCAT mutante. Hicieron una versión de la enzima con una mutación que se ve comúnmente en pacientes con FLD, y luego probó su capacidad para unirse a HDL y convertir el colesterol en presencia o ausencia de la molécula activadora. Estaban emocionados al descubrir que el activador podía revertir parcialmente la pérdida de actividad en las enzimas mutantes, dando como resultado una conversión de colesterol comparable a la enzima normal.
"Nuestros resultados ayudarán a los científicos a diseñar compuestos que puedan dirigirse mejor a la LCAT para que puedan ser de beneficio terapéutico para los pacientes con enfermedades cardíacas y con FLD". "concluye el autor principal John Tesmer, Profesor Walther de Biología Estructural del Cáncer en la Universidad de Purdue, NOSOTROS. "Los esfuerzos futuros consistirán en examinar si los pacientes con otras mutaciones genéticas LCAT podrían beneficiarse de los compuestos utilizados en este estudio," y diseñar moléculas con propiedades farmacológicas mejoradas para un mayor desarrollo ".