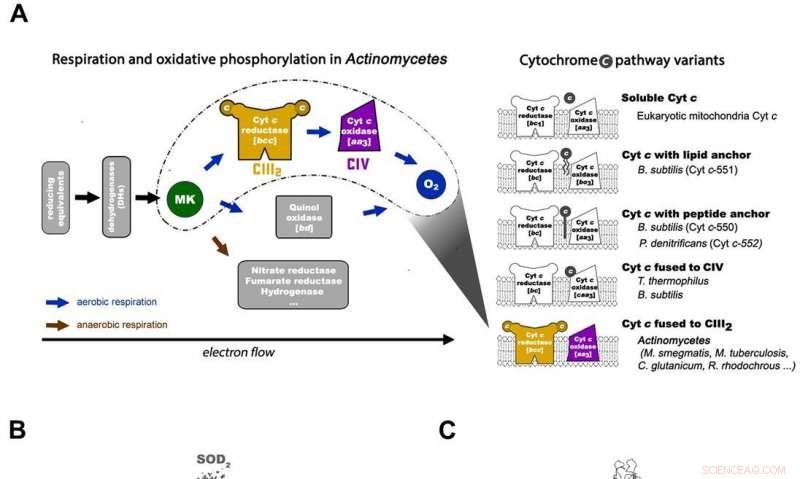
Respiración en actinomicetos y arquitectura general de la máquina respiratoria micobacteriana CIII2CIV2SOD2. A) La cadena de transferencia de electrones respiratorios en actinomicetos (izquierda) y las 5 variantes principales de la vía del citocromo c procariótico con los esquemas de organización en organismos representativos (derecha). La vía del citocromo c de M. smegmas tiene su citocromo c fusionado con el complejo III para formar un complejo III de tipo bcc que interactúa con el complejo IV de tipo aa3 para ensamblarse en un supercomplejo CIII-CIV. MK =menaquinona / menaquinol. B) Toda la arquitectura del supercomplejo respiratorio CIII-CIV tipo bcc-aa3 de M. smegmatis. El mapa crio-EM del supercomplejo muestra una forma lineal dimerizada 2 veces de CIV1-CIII2-CIV1 con dimensiones 200 x 70 x 120 Å. CIII se ve en naranja, CIV es magenta y los factores de asociación PRSAF1 en verde, LpqE en azul y SOD en gris. C) Representación de dibujos animados de la vista lateral del supercomplejo (arriba) y una vista en sección transversal (abajo). El MK se presenta como esferas sólidas de color verde brillante y los fosfolípidos como barras amarillas. En la vista de sección transversal en la parte inferior, los límites de CIII, El CIV y el factor de asociación PRSAF1 se representan en líneas discontinuas de color (naranja para CIII, magenta para CIV y verde para PRSAF1). Crédito: Ciencias , doi:10.1126 / science.aat8923.
En un estudio reciente realizado por Hongri Gong y sus colegas, se aisló un supercomplejo respiratorio de la bacteria Mycobacterium smegmatis, y su estructura se visualizó a una resolución de 3,5 Å utilizando microscopía crioelectrónica (crio-EM). La bacteria es un pariente cercano de M. tuberculosis y un modelo popular utilizado para estudiar muchas otras especies bacterianas. La estructura detallada reveló cómo se transfirieron los electrones en la célula en un proceso nunca antes visto.
Típicamente, La energía química para sintetizar el trifosfato de adenosina (ATP) y las reacciones celulares de potencia se extrae durante la respiración celular mediante el acoplamiento de la oxidación de una fuente de energía (azúcares, ácidos grasos y aminoácidos) y la reducción de un aceptor de electrones (oxígeno, azufre, nitrato y sulfato). En la respiración celular aeróbica, la energía se extrae de los donantes de electrones al aceptor terminal, oxígeno, a través de la cadena de transporte de electrones (ETC) para crear un gradiente de protones transmembrana conocido como fuerza motriz de protones (PMF) que impulsa la síntesis de ATP. Los nuevos resultados ahora publicados en Ciencias revelan un vínculo directo para la transferencia de electrones entre enzimas para representar un nuevo modo de catálisis de la cadena respiratoria.
Las quinonas y los citocromos son dos tipos de portadores de electrones en los ETC que se utilizan para transportar electrones hacia y desde grandes estructuras macromoleculares incrustadas en la membrana. Cuatro oxidorreductasas de membrana están involucradas en la cadena respiratoria mitocondrial para la transferencia de electrones. Estos incluyen el complejo I (NADH:ubiquinona oxidorreductasa, CI), complejo II (succinato:ubiquinona oxidorreductasa, CII), complejo III (bc 1 -tipo ubiquinol:citocromo c oxidorreductasa, antes de Cristo 1 -tipo CIII) y complejo IV (aa 3 -tipo citocromo c oxidasa, Automóvil club británico 3 -tipo CIV). Por función, CIII puede oxidar ubiquinol a ubiquinona y pasar los electrones al citocromo c soluble. Luego, los electrones se transportan al CIV, donde el oxígeno se reduce a agua. El PMF transmembrana se genera mediante bombeo de protones en CI, CIII y CIV.
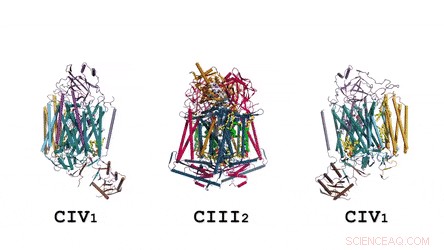
La arquitectura del supercomplejo en su totalidad:la representación de dibujos animados muestra la menaquinona / menaquinol (MK) en esferas sólidas de color verde brillante y fosfolípidos como palos amarillos. Crédito: Ciencias , doi:10.1126 / science.aat8923
En la cadena respiratoria procariota, la situación es más complicada. Aún no se ha determinado una ruta completa del flujo de electrones en el tipo de célula debido a su complejidad. Por lo tanto, es necesario comprender la estructura completa de un "supercomplejo" involucrado durante la transferencia de electrones bacterianos para ayudar al objetivo. En el estudio, los investigadores extrajeron y purificaron el complejo de M. smegmatis para visualizar la arquitectura utilizando microscopía crioelectrónica (crio-EM) a una resolución de 3,5 Å. La estructura proporcionó información crucial sobre el mecanismo de transferencia directa de electrones dentro de un supercomplejo respiratorio. Las dimensiones del supercomplejo estaban en el rango de 200 x 70 x 120 Å, en una arquitectura lineal simetrizada completamente diferente de los supercomplejos respiratorios previamente reportados. Por composición, el CIV dimérico lineal 1 -CIII 2 -CIV 1 se dispuso de manera que los CIV individuales flanquearan el dímero CIII central a cada lado. La información reveló un vínculo directo entre las enzimas durante la transferencia de electrones, representando un nuevo modo de catálisis de la cadena respiratoria. Los hallazgos estructurales detallados tienen potencial para ayudar con los esfuerzos de descubrimiento de fármacos antimicobacterianos.
La composición y estructura del dímero CIII. La menaquinona / menaquinol se presenta como esferas sólidas de color verde brillante y los fosfolípidos son barras amarillas. Crédito: Ciencias , doi:10.1126 / science.aat8923
Durante los experimentos de cultivo de células bacterianas, los autores utilizaron una cepa mutante de M. smegmatis resistente al peróxido de hidrógeno similar a M. tuberculosis. Las células se cultivaron y la membrana se aisló como se describió previamente. Después del cultivo celular, recolección y lisis celular, Se recolectaron sedimentos de membranas celulares para extraer supercomplejos respiratorios. Los supercomplejos se caracterizaron mediante espectroscopia óptica, espectroscopia de masas y 3, Tinción con 3'-diaminobencidina (DAB). Para identificar grupos hemo, las fracciones seleccionadas se analizaron registrando espectros antes y después de la reducción con ditionato como se describió anteriormente. Las muestras purificadas se analizaron mediante espectroscopia de masas nativa para investigar la arquitectura y los componentes estructurales individuales se analizaron utilizando protocolos previamente establecidos.
Durante el análisis crio-EM, los investigadores utilizaron acetato de uranilo (1 por ciento p / v) para tinción negativa, utilizando 5 µl de la muestra supercompleja a una concentración de 0,05 mg / ml, Las imágenes se tomaron en un microscopio FEI Tecnai Spirit que funcionaba a 120 kV para la construcción inicial del modelo. Las imágenes adquiridas se procesaron mediante una reconstrucción de baja resolución del supercomplejo a partir de 53 micrografías de la muestra teñida en negativo. Para la reconstrucción completa del supercomplejo, los autores seleccionaron manualmente 7, 600 micrografías de 8, 200 micrografías originales durante el procesamiento de imágenes crio-EM. Todas las figuras del estudio se crearon utilizando PyMOL o quimera UCSF.

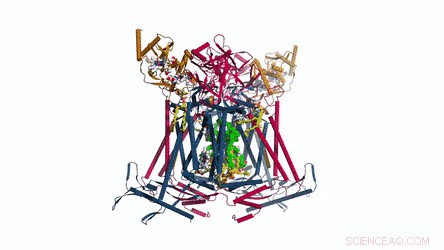
La composición y estructura de CIV. Representación de dibujos animados del complejo IV. Los fosfolípidos se muestran como barras amarillas. Crédito: Ciencias , doi:10.1126 / science.aat8923
Los autores revelaron la estructura crio-EM de un supercomplejo respiratorio CIII-CIV de la bacteria M. smegmatis. La vía de transferencia de electrones intracomplejos varió desde la oxidación de quinol en CIII hasta la reducción de oxígeno en CIV. Los resultados mostraron un nuevo mecanismo para bifurcar la transferencia de electrones para asegurar la finalización del ciclo Q (el movimiento neto de protones a través de una bicapa lipídica) para la transducción de energía. La asociación de una superóxido dismutasa en la arquitectura del sistema puede proteger contra el daño oxidativo por especies reactivas de oxígeno (ROS). La arquitectura de los sitios de unión de quinonas también proporcionó un marco para futuros estudios sobre el descubrimiento de fármacos antimicrobianos basados en estructuras.
© 2018 Science X Network