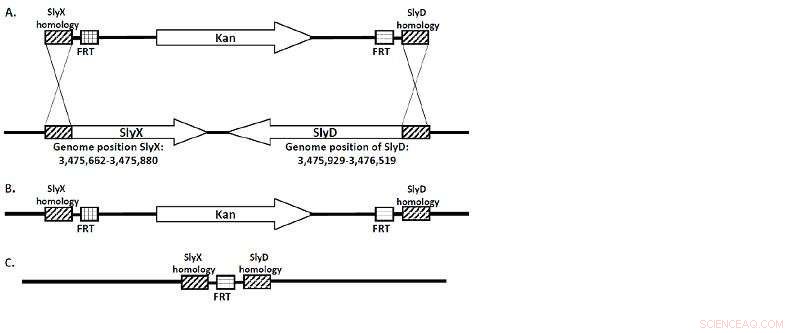
(A) El casete KanR flanqueado por regiones homólogas a SlyX y SlyD. (B) La secuencia completa de estos genes se reemplaza por el casete KanR durante la recombinación. (C) La "cicatriz FRT" es todo lo que queda una vez que la cepa es "curada" por flp-recombinasa. Crédito:Universidad Lobachevsky
Los sistemas bacterianos son algunas de las plataformas más simples y efectivas para la expresión de proteínas recombinantes. Son más rentables en comparación con otros métodos, y, por lo tanto, son de gran interés no solo para los investigadores de la Universidad Lobachevsky, sino también para los fabricantes de medicamentos de importancia terapéutica.
Sin embargo, además de las proteínas recombinantes diana, Las células también producen una gran cantidad de proteínas endógenas, incluido SlyD. Es una pequeña proteína que consta de tres dominios. Su región C-terminal es rica en residuos de histidina, y SlyD, por lo tanto, exhibe una alta afinidad por los iones 2-valentes y se purifica junto con las proteínas diana en el curso de la cromatografía de afinidad por metales. Esto da como resultado la necesidad de pasos de purificación adicionales, y como consecuencia, aumenta el costo del proceso tecnológico para la obtención de proteínas recombinantes terapéuticas.
Un equipo de investigadores de la Universidad Lobachevsky dirigido por el profesor Viktor Novikov, Director del Centro de Biología Molecular y Biomedicina de la UNN, ha obtenido una serie de cepas de E. coli deficientes en los genes SlyD / SlyX. Las cepas se diseñaron mediante la utilización de una deleción cromosómica mediada por λ-red. (Figura 1.)
"La secuencia de SlyD / SlyX en el genoma de E. coli fue reemplazada por un gen responsable de la resistencia al antibiótico kanamicina que estaba flanqueado en ambos lados por sitios FRT, de donde más tarde fue eliminado por FLP recombinasa, "Observa Viktor Novikov.
Utilizando el ejemplo de la proteína biespecífica recombinante MYSTI-2 que consta de dos módulos que son centros activos de anticuerpos contra las proteínas de ratón F4 / 80 y TNF, los científicos compararon la actividad de las proteínas aisladas de las cepas originales y mutantes. Como resultado del estudio, se determinó que la eliminación del genoma de E. coli de los genes SlyD y SlyX, que presumiblemente codifican chaperones que apoyan la estructura espacial de las proteínas de Escherichia coli, no da como resultado una interrupción de la actividad funcional de las proteínas recombinantes.
Al obtener cepas originales de E. coli, los investigadores pudieron resolver el problema de la contaminación de proteínas recombinantes y asegurar su purificación exitosa en una sola etapa mediante cromatografía de afinidad por metales.
"El conjunto obtenido de cepas de E. coli deficientes en slyD / slyX se puede utilizar para producir en forma pura una amplia gama de proteínas procariotas y eucariotas, incluyendo proteínas terapéuticas médicas. Esto facilita el desarrollo y la producción de nuevos preparados biológicos medicinales y preventivos, más simple y económico, "concluye Viktor Novikov.