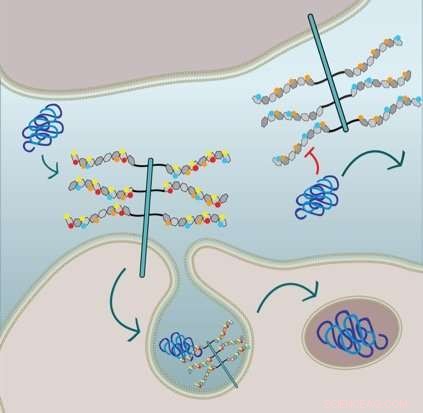
La figura muestra que la captación de fibrillas de tau celular requiere 6-O-sulfatación y N-sulfatación de las cadenas laterales de HSPG:la célula en la mitad inferior expresa HSPG con todos los restos de sulfato e internaliza tau a través de macropinocitosis. La celda en la mitad superior está genéticamente modificada y carece de N-sulfatación (círculos rojos) y 6-O-sulfatación (círculos amarillos) y, por lo tanto, se inhibe la captación de fibrillas de tau. Crédito:Sandi Jo Estill-Terpack, Barbara Stopschinsky
Los vampiros pueden convertir a los humanos en vampiros, sino entrar en la casa de un humano, deben ser invitados a entrar. Investigadores del UT Southwestern Medical Center, escribiendo en el Revista de química biológica , han descubierto detalles de cómo las células invitan al interior de proteínas corruptas que pueden convertir las proteínas normales en corruptas, que conduce a enfermedades neurodegenerativas como las enfermedades de Alzheimer y Parkinson. Comprender los detalles moleculares de cómo estas proteínas se propagan de una célula a otra podría conducir a terapias para detener la progresión de la enfermedad.
El Alzheimer y el Parkinson están asociados con proteínas particulares en el plegamiento incorrecto del cerebro, agregando, e inducir a las proteínas normales a plegarse incorrectamente y agregarse. El grupo de Marc Diamond en UT Southwestern descubrió en 2013 que para ingresar a nuevas celdas y propagar el plegado incorrecto, las proteínas tau asociadas a la enfermedad, La alfa-sinucleína y la beta-amiloide deben unirse a un tipo de molécula de proteína de azúcar llamada proteoglicano heparán sulfato (HSPG) en la superficie de la célula. Esta unión hace que la célula lleve la proteína dañada al interior. En el nuevo estudio, el grupo buscó comprender más sobre cómo funcionaba este proceso.
"La pregunta era, ¿Qué tan específico es este (proceso)? ¿O no es específico en absoluto? ", Preguntó Barbara Stopschinski, el médico e investigador del laboratorio de Diamond que supervisó el nuevo trabajo. ¿Cuáles fueron los detalles de la comunicación química entre HSPG y tau que desencadenaron la entrada de tau en las células? ¿Y fue este proceso diferente para la alfa-sinucleína (asociada con la enfermedad de Parkinson), beta amiloide y tau (ambos asociados con la enfermedad de Alzheimer)?
Las HSPG pueden ser de diferentes tamaños y estructuras; se pueden decorar con diferentes patrones de azúcares, y los azúcares pueden contener por sí mismos diferentes patrones de grupos que contienen azufre (restos de sulfato). Stopschinski probó sistemáticamente cómo los diferentes patrones de restos de sulfato afectaban la unión y la captación en las células de la alfa-sinucleína, beta amiloide y tau.
Descubrió que la tau mal plegada podía entrar en las células sólo a través de un HSPG modificado y decorado de forma muy específica. Beta amiloide y alfa-sinucleína, por otra parte, fueron más flexibles en los tipos de restos de sulfato que desencadenaron su absorción. Es más, Stopschinski identificó las enzimas en las células que creaban patrones de sulfatación particulares en las HSPG. Cuando se eliminaron estas enzimas, tau mal plegado ya no se llevó a las celdas, presumiblemente porque las decoraciones de azúcar HSPG y los patrones de sulfatación cambiaron, lo que significa que tau mal plegado ya no conocía la contraseña molecular.
El equipo ahora quiere comprender si estos procesos funcionan de la misma manera en el cerebro que en los cultivos de células cerebrales. Diamond espera que la comprensión de cómo se mueven las proteínas corruptas entre las células cerebrales permita encontrar formas de detenerlas.
"Hay algo muy notable en la eficiencia con la que una célula absorberá estos agregados, tráelos adentro y úselos para hacer más, "Dijo Diamond." Este conocimiento tiene implicaciones importantes para nuestra comprensión de cómo las enfermedades neurodegenerativas empeoran con el tiempo. Debido a que hemos identificado enzimas específicas que pueden inhibirse para bloquear este proceso, esto podría conducir a nuevas terapias ".