
El experimento se realizó en el instrumento Coherent X-ray Imaging (CXI), que hace uso del rápido, pulsos de rayos X brillantes de la fuente de luz coherente Linac. CXI aplica el método de "difracción antes de la destrucción" para tomar medidas con pulsos de rayos X ultracortos antes de que dañen sus objetivos. Crédito:Laboratorio del Acelerador Nacional SLAC
Tuberculosis, una enfermedad pulmonar que se propaga en el aire al toser o estornudar, ahora mata a más personas en todo el mundo que cualquier otro agente infeccioso, según el último informe mundial sobre tuberculosis de la Organización Mundial de la Salud. Y en cientos de miles de casos cada año, el tratamiento falla porque las bacterias que causan la tuberculosis se han vuelto resistentes a los antibióticos.
Ahora, un equipo internacional de investigadores ha encontrado una nueva forma de investigar cómo las bacterias Tb inactivan una importante familia de antibióticos:observaron el proceso en acción por primera vez utilizando un láser de rayos X de electrones libres. o XFEL.
En experimentos en el Laboratorio Nacional Acelerador SLAC del Departamento de Energía, mezclaron un antibiótico con una enzima llamada beta-lactamasa que usan las bacterias Tb, y luego observó en tiempo real cómo la enzima atacaba al antibiótico para desactivarlo.
El método de los investigadores, llamada cristalografía en serie de mezcla e inyección, aprovecha lo brillante, pulsos ultrarrápidos producidos por la fuente de luz coherente Linac (LCLS) de SLAC. Las instantáneas de rayos X tomadas de 30 milisegundos a 2 segundos después de que comenzara la reacción mostraron que la lactamasa se unía al antibiótico, ceftriaxona, y rompiendo uno de sus enlaces químicos.
Los resultados del experimento se publicaron hoy en Biología BMC .
"Este estudio de prueba de concepto muestra que podemos ver la forma y las etapas intermedias de las moléculas durante el proceso, "dice Marius Schmidt, un profesor de la Universidad de Wisconsin Milwaukee que dirigió el experimento. "Después de décadas de probar otras técnicas en el campo de la cristalografía, la tecnología está aquí ".
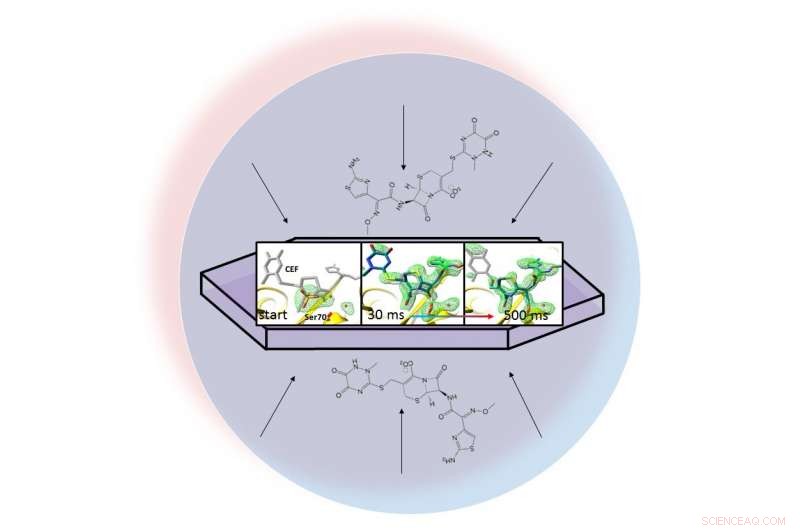
En una gota de líquido (representada por el círculo azul claro), un antibiótico se dispersa a través de una proteína cristalizada, beta-lactamasa, y se une a él. Las instantáneas de rayos X del par unido permitieron a los investigadores crear mapas de la densidad de electrones (verde) y observar un anillo en el antibiótico abrirse (extremo derecho) 30 a 500 milisegundos después de que comenzara la reacción. Crédito:Marius Schmidt / Universidad de Wisconsin Milwaukee
En cristalografía, Los científicos forman un cristal a partir de muchas copias de una proteína y golpean el cristal con rayos X para producir un patrón de difracción en un detector. que revela la estructura atómica de la proteína. Esta estructura es clave para comprender cómo funcionan las enzimas y otras proteínas.
En el pasado, esto solo funcionaba con cristales relativamente grandes, que tienen un valor limitado en este método porque la solución que contiene el antibiótico tardaría mucho en difundirse en el cristal y reaccionar con la enzima. Es importante que la difusión sea más rápida que la reacción, de modo que las muchas moléculas de proteína en el cristal inician el proceso químico juntas.
Pero LCLS y otros XFEL tienen haces tan intensos que pueden capturar patrones de difracción de cristales mucho más pequeños, una millonésima de metro de ancho o menos, Schmidt dijo:para que el antibiótico llegue a la enzima rápidamente, y la reacción se puede registrar con rayos X.
"Si bien se han realizado estudios elegantes para observar los movimientos de las proteínas con cambios inducidos por la luz, Nuestro trabajo ilustra que una clase más grande de proteínas, a saber, enzimas, se puede investigar de manera resuelta en el tiempo en LCLS y otros XFEL, "dice José Olmos, estudiante de doctorado en la Universidad de Rice, quien es uno de los principales autores de la publicación.
En este estudio, el equipo de investigación entregó pequeños cristales de beta-lactamasa mientras los mezclaba con el antibiótico solo fracciones de segundo antes de que fueran golpeados con pulsos de rayos X.
Crédito:CC0 Public Domain
El equipo tomó millones de instantáneas de rayos X durante la reacción y las unió para crear un mapa que muestra los cambios en la estructura tridimensional del antibiótico a medida que interactúa con la enzima a temperatura ambiente.
"Para los biólogos estructurales, así es como aprendemos exactamente cómo funciona la biología, "dice Mark Hunter, científico de planta de SLAC y coautor del estudio. "Desciframos la estructura de una molécula en un momento determinado, y nos da una mejor idea de cómo funciona la molécula ".
En experimentos futuros, tomar aún más instantáneas durante el curso de la reacción podría proporcionar un mayor detalle de la estructura y el comportamiento químico de la lactamasa. Con más información, los científicos podrían manipular el diseño de antibióticos para prevenir tales ataques. El método experimental también podría aplicarse para conocer los detalles de otros tipos de procesos biológicos en los que las enzimas inician o dirigen reacciones.
"Hay una gran cantidad de entusiasmo por este método, porque abre este nuevo reino del tiempo para los biólogos estructurales, ", Dice Hunter. El trabajo anterior que utilizó esta técnica capturó el movimiento de un interruptor de ARN, "importante para estudios sobre retrovirus y cáncer.
Los científicos planean usar el método para buscar antibióticos adicionales. También tienen la intención de aprovechar las tasas de repetición más altas (disparo más rápido de pulsos de rayos X) que se esperan en una futura actualización a LCLS y en el XFEL europeo recientemente inaugurado. Esto permitirá a los científicos capturar los datos que necesitan en solo minutos, en comparación con los días. También podrían tomar instantáneas más cercanas de las reacciones, lo que podría dar una imagen aún más completa de la rápida química que ocurre.