
Ver en la cámara de ultra alto vacío (muestra de catalizador en el medio). Crédito:Universidad Tecnológica de Viena
En Quimica, los átomos generalmente solo pueden afectar a su vecindad inmediata. En TU Viena, Se ha descubierto un efecto novedoso con una asombrosa acción de largo alcance, lo que puede hacer que los convertidores catalíticos para automóviles sean más efectivos.
El sabor del glaseado de la tarta de chocolate no debe depender de si se sirve en un plato de porcelana o de plata. Similar, para reacciones químicas en la superficie de grandes granos de metales preciosos, el sustrato (el llamado soporte) no debe jugar un papel crucial. Los granos catalíticos a menudo tienen un diámetro que abarca muchos miles de átomos, y el soporte sobre el que descansan no debería afectar las reacciones químicas en el otro lado lejos de la interfaz, al menos esto se creía hasta la fecha.
Los estudios experimentales realizados en TU Wien llevaron a hallazgos sorprendentes. Procesos químicos en granos de paladio, que también se utilizan para catalizadores de gases de escape, cambiaron significativamente cuando se colocaron sobre materiales de soporte específicos, a pesar de que el material del soporte es casi inactivo en la reacción química en sí. Esta nueva perspectiva se ha publicado ahora en la revista Materiales de la naturaleza .
Monóxido de carbono tóxico
Para vehículos que utilizan un motor de combustión interna, El monóxido de carbono (CO) tóxico debe convertirse en dióxido de carbono (CO2). Esto se logra mediante el uso de catalizadores que contienen paladio o platino en polvo. "Hemos investigado reacciones químicas en granos de polvo, que se utilizan a menudo en catálisis industrial, "dice el profesor Günther Rupprechter del Instituto de Química de Materiales en TU Wien." Los granos de metales preciosos tienen un diámetro del orden de 100 micrómetros; esto es muy grande para los estándares de la nanotecnología, casi se pueden ver a simple vista ".
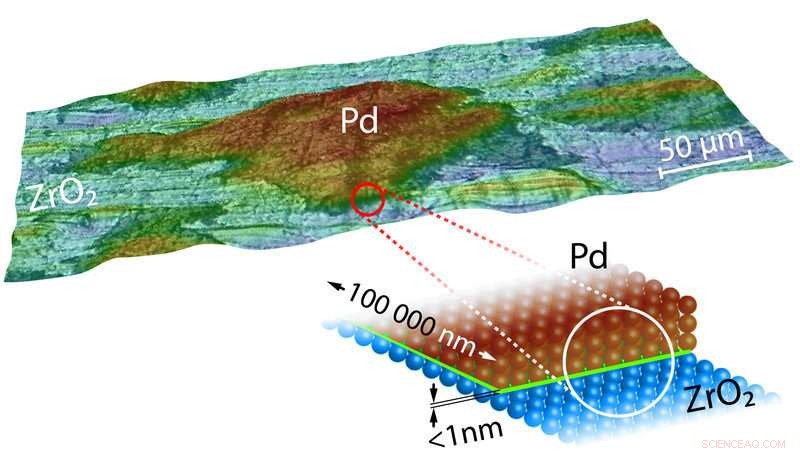
Imagen tridimensional y dibujo modelo de un Pd-ZrO 2 Catalizador. La interfaz / límite esencial es de color verde en el modelo. Crédito:Universidad Tecnológica de Viena
Cuando la superficie de las partículas de polvo está cubierta por átomos de oxígeno, Las moléculas de CO reaccionan con ellos y se transforman en CO2, dejando sitios vacíos (agujeros) en la capa de oxígeno. Estos sitios deben llenarse rápidamente con otros átomos de oxígeno para sostener la catálisis. Sin embargo, este ya no es el caso cuando las moléculas de CO llenan estos huecos en lugar de oxígeno. Si esto sucede a gran escala, la superficie del catalizador ya no está cubierta por una capa de oxígeno sino por una capa de CO, y de este modo ya no se puede formar CO2. Este fenómeno se denomina "intoxicación por monóxido de carbono", desactiva el catalizador.
El soporte influye en todo el grano
Que esto suceda o no depende de la concentración de CO en el gas de escape suministrado al catalizador. Sin embargo, como muestran los experimentos actuales, el material de soporte sobre el que se colocan los granos de paladio también es fundamental. "Si los granos de paladio se colocan sobre una superficie de óxido de circonio u óxido de magnesio, entonces el envenenamiento del catalizador ocurre a concentraciones mucho más altas de monóxido de carbono, "dice el profesor Yuri Suchorski, el primer autor del estudio. A primera vista, esto es muy sorprendente para granos de paladio tan grandes. ¿Por qué la naturaleza del soporte debería tener un efecto sobre las reacciones químicas que tienen lugar en la superficie de todo el grano de metal? ¿Por qué debería la línea de contacto entre el grano de paladio y el sustrato, que tiene solo unas pocas décimas de nanómetro de ancho, influir en el comportamiento de los granos de paladio que son cien mil veces más grandes?
Este rompecabezas finalmente podría resolverse con la ayuda del microscopio electrónico de fotoemisión especial en el Instituto de Química de Materiales en TU Wien. Con este dispositivo, la propagación espacial de una reacción catalítica se puede controlar en tiempo real. "Podemos observar claramente que la intoxicación por monóxido de carbono siempre comienza en el borde de un grano, exactamente donde entra en contacto con el soporte, "explica el profesor Yuri Suchorski." A partir de ahí, el "envenenamiento por monóxido de carbono" se esparce como una ola de tsunami por todo el grano ".

Observe la cámara de ultra alto vacío (muestra de catalizador en el medio) y la imagen PEEM "in situ" de un frente de reacción de CO. Crédito:Universidad Tecnológica de Viena
El monóxido de carbono ataca mejor en la frontera
Es principalmente por razones geométricas que la onda de envenenamiento comienza exactamente allí:los átomos de oxígeno en el borde del grano tienen menos átomos de oxígeno vecinos que los de la superficie interior. Cuando se abren sitios gratuitos allí, Por lo tanto, es más fácil para una molécula de CO poblar estos sitios que esos sitios en algún lugar en el medio de la superficie libre, donde el CO reaccionaría fácilmente con otros átomos de O alrededor. Además, no es fácil para otros átomos de oxígeno llenar áreas vacías en la frontera, dado que los átomos de oxígeno siempre vienen en pares, como moléculas de O2. Por lo tanto, para llenar un sitio vacío, O2 necesita dos sitios gratuitos uno al lado del otro, y no hay mucho espacio para esto en la frontera.
El límite donde el grano de paladio está en contacto directo con el soporte es, por tanto, de gran importancia estratégica, y exactamente en esta interfaz el soporte puede influir en las propiedades del grano metálico:"Cálculos de nuestros socios de cooperación de la Universidad de Barcelona muestran que el enlace entre los átomos metálicos del grano y la capa protectora de oxígeno se refuerza precisamente en el límite del soporte, ", dice el profesor Günther Rupprechter. Los átomos de paladio en contacto íntimo con el soporte oxídico pueden, por lo tanto, unir el oxígeno más fuerte.
Se puede suponer que esto no importa para los sitios de metal alejados del borde del grano, porque el soporte solo puede influir energéticamente en los átomos en la frontera, y estos son solo muy pocos, en comparación con el número total de átomos en el grano de paladio. Sin embargo, porque la intoxicación por monóxido de carbono comienza en la frontera, este efecto es de gran importancia estratégica. El borde de óxido de metal es de hecho el "punto débil" del grano, y si este punto débil se refuerza (las propiedades catalíticas de los átomos de metal en el borde se ven afectadas positivamente por el soporte), todo el grano de catalizador de tamaño micrométrico está protegido del envenenamiento por monóxido de carbono.
"Ya se utilizan varios soportes de óxido en los catalizadores, pero su papel exacto durante la catálisis en términos de envenenamiento por CO aún no se ha observado directamente ", dice el profesor Günther Rupprechter." Con nuestros métodos, el proceso en curso y su efecto de largo alcance en forma de onda se visualizaron directamente por primera vez, y esto abre nuevas y prometedoras rutas hacia la mejora de los catalizadores del futuro ".