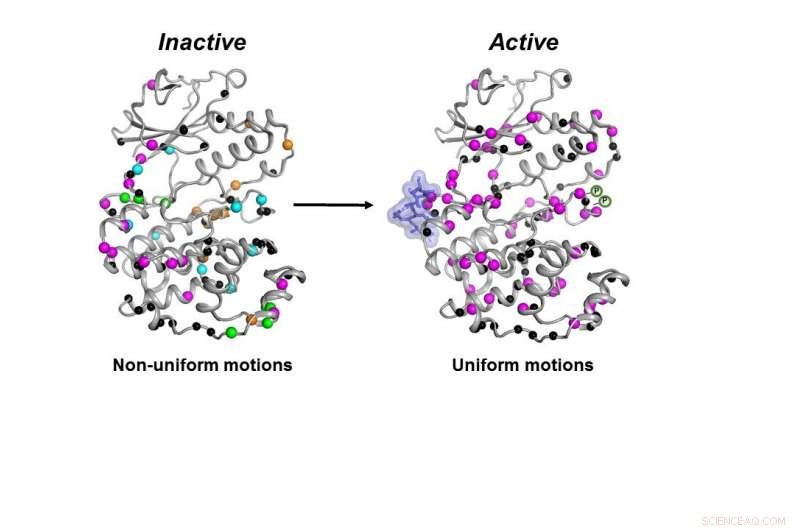
La forma inactiva (izquierda) de la enzima MAPK p38 se mueve de manera descoordinada. Una vez que las moléculas necesarias (burbuja azul y símbolos P) se unen, la enzima se activa (derecha) moviéndose de manera coordinada para hacer su trabajo dentro de una célula. Crédito:Senthil Ganesan, Departamento de Química y Bioquímica de la Universidad de Arizona.
Revelar todos los pasos necesarios para activar una enzima llamada proteína quinasa puede identificar nuevas formas de atacar el cáncer, según una nueva investigación dirigida por la Universidad de Arizona.
La quinasa no solo debe tener todas las piezas necesarias en su lugar, la enzima debe moverse de la manera correcta y a la velocidad correcta para funcionar correctamente en una célula, los investigadores encontraron.
Primer autor Senthil Kumar Ganesan, un profesor asistente de investigación de la UA de química y bioquímica, dichas quinasas son interruptores que activan o desactivan ciertos procesos celulares. Si las quinasas de una célula dejaron de funcionar, la celda moriría.
El equipo dirigido por UA es el primer grupo en descubrir la vía completa para activar una proteína quinasa, dijo el autor principal Wolfgang Peti, quien tiene la Cátedra Homer C. y Emily Davis Weed Endowed en Química en la Universidad de Arizona.
"Las quinasas son uno de los principales objetivos de los medicamentos contra el cáncer, "dijo Peti, quien también es miembro del Instituto UA BIO5 y del Centro Oncológico de la UA. "Si sabe cómo funciona una quinasa, definitivamente puedes diseñar mejor tus medicamentos contra él ".
Es probable que el desarrollo de un medicamento que aproveche este nuevo hallazgo de investigación lleve al menos 10 años, él dijo.
Los medicamentos contra el cáncer que ya están en uso y que se dirigen a las quinasas son dasatinib e imatinib para la leucemia mieloide crónica y afatinib para el carcinoma de pulmón de células no pequeñas. Dijo Ganesan.
Para observar una quinasa llamada proteína quinasa activada por mitógenos (MAPK) p38 en acción, los investigadores utilizaron espectroscopía de resonancia magnética nuclear (RMN).
Todas las moléculas necesarias tenían que unirse a p38 para que la enzima se activara. Solo entonces la enzima podría moverse correctamente para hacer su trabajo en la célula, los investigadores encontraron.
"Descubrimos cómo se mueve para hacer su trabajo y cuál es la contribución de la velocidad de movimiento a su trabajo, "Dijo Peti.
El hallazgo sugiere que una nueva vía para desarrollar medicamentos contra el cáncer podría ser la creación de medicamentos que interfieran con el movimiento de p38. él dijo.
"Estamos entusiasmados porque esta quinasa pertenece a una familia de quinasas que se llaman MAP quinasas, quinasas de señalización clave que regulan una gran cantidad de vías (dentro de las células), " él dijo.
Peti dijo que el nuevo hallazgo podría aplicarse a otras quinasas. Dijo que las muchas enzimas quinasas en el cuerpo son muy similares y probablemente tienen vías de activación similares.
Ganesano Peti y sus coautores publicaron el artículo, "Activación dinámica y regulación de la proteína quinasa p38 activada por mitógenos, "en la edición del 1 de mayo de procedimientos de la Academia Nacional de Ciencias .
Sus coautores son Michael W. Clarkson y Rebecca Page de la Universidad de Arizona; Micha B. A. Kunze, Daniele Granata y Kresten Lindorff-Larsen de la Universidad de Copenhague en Dinamarca; y A. Joshua Wand de la Universidad de Pennsylvania en Filadelfia.
La subvención de los Institutos Nacionales de Salud NIH-R01GM100910 financió la investigación. Los datos se recopilaron en las instalaciones de UA Molecular Structures Core y Brown University Structural Biology Core.
Una analogía muy utilizada de cómo funcionan las enzimas es la de un candado y una llave. Una molécula en particular, la clave, encaja en un sitio de la enzima, La cerradura. Una vez que la llave está en la cerradura, la enzima puede empezar a funcionar.
La llave en la cerradura es necesaria para que funcione una enzima, pero activar una enzima no siempre es tan sencillo. Algunos científicos han sugerido que la dinámica, la forma y la velocidad a la que se mueve una enzima, es importante para activar las enzimas quinasas.
Peti está interesado en cómo las moléculas como las quinasas gobiernan los procesos con las células, por eso quiso investigar el papel que juega la dinámica. Aprender más sobre cómo funcionan las moléculas dentro de las células puede ayudar a desarrollar medicamentos dirigidos a combatir el cáncer y otras enfermedades.
Descubrir el papel que juega la dinámica en la activación de p38 fue más difícil y tomó más tiempo de lo esperado.
La herramienta que utilizan los científicos para observar una enzima en acción, Espectroscopia de RMN, es más difícil con una molécula grande como p38. Además, el equipo tuvo que desarrollar un nuevo software informático para analizar los resultados, Peti dijo.
Los investigadores observaron la enzima durante una serie de pasos mientras varias moléculas clave se unían a p38. Algunas enzimas se activan cuando las moléculas clave se unen, pero no esta.
"Si cree que es un proceso de cinco o seis pasos para pasar de cero a 100, pensamos que en los pasos cero, uno, dos o tres, obtendríamos indicaciones o pautas, "Dijo Peti.
Eso no sucedió. Dijo que los investigadores pensaron en darse por vencidos.
"Nada estaba funcionando, y parecía que nuestra hipótesis estaba completamente equivocada, " él dijo.
"Lo que tenemos es que no pasa nada de cero a uno, no pasa nada del uno al dos, no pasa nada de dos a tres, no pasa nada de tres a cuatro, "Peti dijo." Cuando pasas de cuatro a cinco:¡Boom! De repente estaba allí ".
Una vez que se hayan completado todos esos pasos, aunque la forma de p38 no cambió, su dinámica lo hizo, dijo, y que se requería un cambio final en la dinámica para que la enzima funcionara.
El siguiente paso del equipo, Peti dijo, está viendo si el movimiento de las quinasas juega un papel en la diabetes.