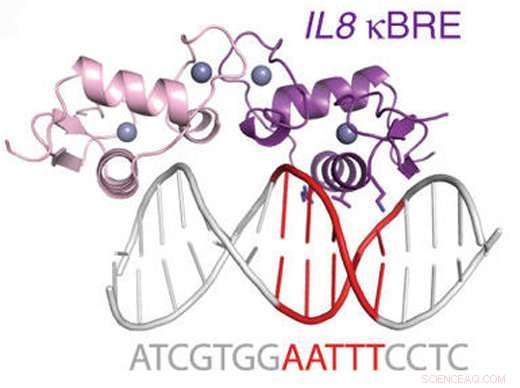
Figura:Diagrama del receptor de glucocorticoides que se une a un sitio NF-kappaB. Crédito:Hudson et al, Nature Communications (2018).
Los medicamentos antiinflamatorios como la dexametasona pueden tener efectos secundarios dañinos en la piel, huesos y metabolismo. La investigación en biología estructural de la Facultad de Medicina de la Universidad de Emory tiene implicaciones para la búsqueda de larga data para separar los beneficios de estos medicamentos de sus efectos secundarios.
Los hallazgos fueron publicados recientemente en Comunicaciones de la naturaleza .
La dexametasona es una hormona glucocorticoide sintética, utilizado para tratar afecciones como alergias, asma, enfermedades autoinmunes y cáncer. Imita la acción de la hormona natural cortisol. Tanto el cortisol como las hormonas sintéticas actúan uniéndose a la proteína del receptor de glucocorticoides (GR).
GR puede unirse al ADN de dos modos. En algunos sitios, se empareja o "dimeriza" - activando genes. En otros, se une uno a la vez, apagando los genes. Para medicamentos dirigidos a GR, Se cree que los efectos secundarios provienen de activar genes involucrados en procesos como el metabolismo y el crecimiento óseo. mientras que los efectos antiinflamatorios deseados resultan principalmente de desactivar los genes del sistema inmunológico e inflamatorio.
En su nuevo periódico, Eric Ortlund, Doctor., y sus colegas informan que la capacidad de GR para unirse directamente al ADN se extiende más ampliamente de lo que se pensaba anteriormente. El primer autor es Will Hudson, Doctor., anteriormente estudiante de posgrado en Ortlund y ahora becario postdoctoral en el laboratorio de Rafi Ahmed en Emory Vaccine Center.
Se sabía que GR interfiere con otra importante proteína de unión al ADN llamada NFkB, un regulador maestro de la inflamación. El equipo de Ortlund descubrió que GR puede unirse directamente de uno en uno a muchos de los mismos tramos de ADN con los que interactúa NFkB.
"Este tipo de interacción, donde GR actúa uno a la vez, creemos que se puede drogar, "dice Ortlund, quien es profesor asociado de bioquímica en la Facultad de Medicina de la Universidad de Emory.
Agrega que los hallazgos del artículo podrían conducir a la reinterpretación de varios estudios en el campo de la regulación de genes inflamatorios. GR se propuso anteriormente para interactuar con los sitios NFkB mediante "tethering, "basado en interacciones proteína-proteína.
Ortlund señala que las mutaciones que interfieren con la capacidad de GR para dimerizar no afectan su capacidad para reducir la inflamación. Por otra parte, las mutaciones que interrumpen su capacidad para unirse al ADN frustran sus funciones de activación y represión.
Los investigadores midieron la afinidad entre la proteína GR y el ADN en los sitios de unión de NFkB y demostraron que era similar a otras interacciones impulsadas por hormonas por las que GR era bien conocido. También probaron el modo de interacción entre la proteína GR y los sitios de unión de NFkB, utilizando cristalografía de rayos X y RMN (resonancia magnética nuclear). Demostraron que GR une esos sitios de uno en uno, en una región que en realidad se encuentra entre los dos tramos de ADN contactados por la propia NFkB.
¿Están ocurriendo los mismos tipos de interacciones en las células? Hudson, Ortlund y sus colegas volvieron a analizar los datos de otros para mostrar que la unión directa al ADN de uno en uno por GR podría ser responsable de la represión de muchos genes de inflamación.