Crédito objetivo de proteínas:Elena Khavina / MIPT
Investigadores del MIPT y de varias universidades estadounidenses y chinas han resuelto la estructura de una de las proteínas más importantes del sistema nervioso en un complejo con varias moléculas de fármacos. El descubrimiento abre oportunidades para desarrollar nuevos medicamentos con acción regulada y menos efectos secundarios. El artículo fue publicado en la revista Celda .
Muchos fármacos modernos se dirigen a las proteínas, ya que son responsables de la mayoría de las reacciones físicas y químicas en una célula. Las moléculas de proteína también permiten que las células se comuniquen transmitiendo señales entre ellas. Cuando una persona se enferma, la armonía en las células se interrumpe, por lo que se utilizan fármacos para recuperar el equilibrio aumentando o reduciendo temporalmente la actividad de las proteínas. Muchos de ellos cumplen funciones similares y tienen estructuras casi idénticas, lo que significa que un medicamento puede afectar a varios tipos de proteínas. Esta capacidad de los fármacos para interactuar con múltiples objetivos proteicos se denomina polifarmacología.
Cuando se introdujo por primera vez el enfoque molecular para el desarrollo de fármacos, una noción general entre los farmacólogos era que la eficacia de los medicamentos dependía de cómo un medicamento en particular interactuaba con una proteína determinada. La interacción con otros tipos de proteínas, sin embargo, se pensaba que solo causaba efectos secundarios adversos. Entonces en ese entonces el principal objetivo de la farmacología era maximizar la selectividad, es decir, la capacidad de un fármaco para dirigirse solo a un tipo específico de proteínas. El concepto recibió un nombre metafórico del ganador del Premio Nobel Paul Ehrlich, quien acuñó el término "balas mágicas" para referirse a medicamentos tan selectivos.
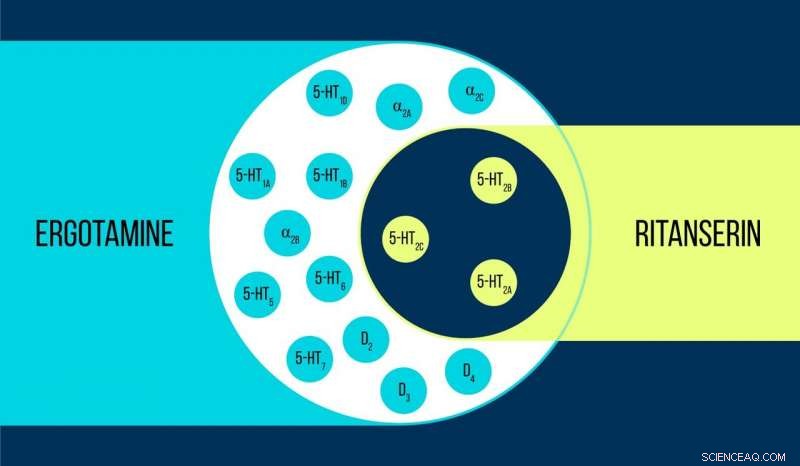
Comparación de ergotamina y ritanserina Crédito:Elena Khavina / MIPT
Sin embargo, como suele suceder, el concepto más simple no es necesariamente el más exitoso. Los avances en las tecnologías informáticas en química y biología hicieron posible producir fármacos extremadamente selectivos que actuaban solo sobre dos o tres subtipos cercanos de una proteína diana. Pero no fueron tan efectivos como sus análogos de baja selectividad en el tratamiento de trastornos complejos como la depresión:los perfiles polifarmacológicos de algunos fármacos demostraron ser importantes por sus efectos beneficiosos. Resultó que la polifarmacología no necesariamente causa efectos secundarios adversos, sin embargo, es importante controlar qué proteínas se ven afectadas. La noción de "bala mágica" fue reemplazada por el concepto de "escopeta mágica", que enfatiza las drogas con un efecto deseado en una combinación particular de objetivos.
El propósito de esta investigación fue identificar las características estructurales de las proteínas que explicarían por qué algunos fármacos actúan sobre ellas de forma selectiva y otros no. Para realizar el estudio, los científicos utilizaron el receptor de serotonina 5-HT2c, una proteína de señalización ubicada en la membrana celular, que se activa con la serotonina para recibir señales de las células vecinas. El receptor tiene varias características importantes. Primero, ya se utiliza como un objetivo validado para la medicación contra la obesidad, además de ser un objetivo terapéutico potencial para varios trastornos mentales. Segundo, está dirigido por una serie de medicamentos con una amplia gama de selectividades, haciendo posible compararlos. En tercer lugar, un cuerpo humano tiene más de 800 receptores que son similares en estructura al 5-HT2c pero cumplen funciones diferentes. Es por eso que sus antagonistas no selectivos suelen tener multitud de efectos secundarios.
Vsevolod Katritch, profesor invitado en MIPT, dice, "Utilizamos dos sustancias químicas para trabajar con el receptor de serotonina 5-HT2c:ergotamina y ritanserina. La ergotamina es un agonista no selectivo con un amplio perfil polifarmacológico:influye en la serotonina, dopamina y receptores adrenérgicos. Ritanserina, por el contrario, tiene un perfil más estrecho [figura 1] y es el agonista inverso selectivo del receptor 5-HT2c. Por lo tanto, las estructuras atómicas de 5-HT2c obtenidas en complejo con ergotamina y ritanserina ayudan no sólo a explicar las diferencias entre los estados del receptor activo e inactivo, lo cual es en sí mismo un logro considerable, sino también a descubrir las razones de tal selectividad molecular ".
Crédito:Instituto de Física y Tecnología de Moscú
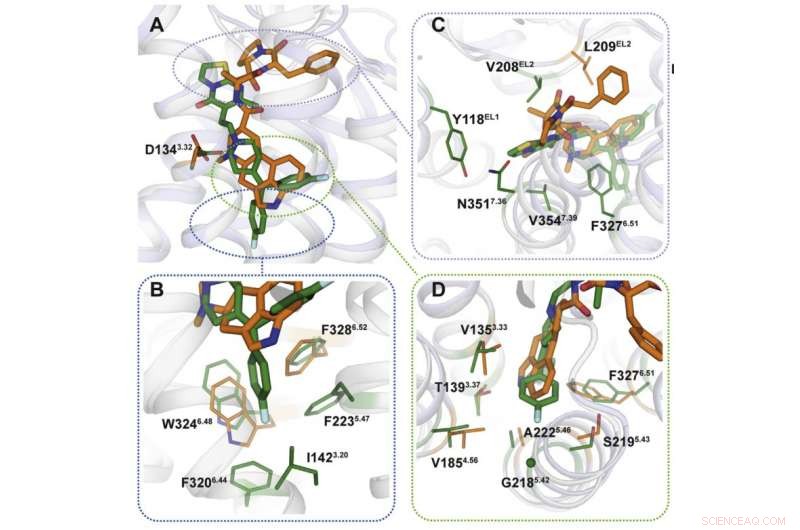
Usando cristalografía de rayos X, los científicos obtuvieron un modelo tridimensional de proteínas en el momento de su interacción con fármacos. Como era de esperar, los mecanismos de unión de los medicamentos fueron diferentes (figura 2). Los sitios de unión a los que se dirige la ergotamina son similares en muchas proteínas, lo que explica la no selectividad de la sustancia química. Ritanserina, por otra parte, interactúa con el receptor de manera diferente y solo actúa sobre algunos de sus fragmentos que son exclusivos de un pequeño grupo de proteínas. Introduciendo varias mutaciones que cambian estos fragmentos en el gen del receptor 5HT2c, los investigadores notaron que la interacción con la ritanserina se volvió menos efectiva, hecho que confirmó que esas áreas proteicas son las responsables de la selectividad de la sustancia química.
Petr Popov, investigador del Laboratorio de Biología Estructural de Receptores Acoplados a Proteína G del MIPT, dice, "El principal desafío en la identificación de las estructuras de los receptores fue obtener un construcción genéticamente modificada que sería adecuada para la cristalización y con la que podríamos trabajar y estudiar. Utilizando el enfoque bioinformático y los métodos de aprendizaje automático, hemos identificado mutaciones puntuales estabilizadoras para el receptor 5HT2c tanto en su estado activo como inactivo ".
Por lo tanto, el análisis de las características estructurales de las proteínas en complejo con fármacos de selectividad variable demostró ser eficaz. Puede utilizarse para controlar el conjunto de objetivos y, por tanto, los efectos directos y secundarios de un medicamento durante su desarrollo. También, Estos medicamentos beneficiarán a muchos pacientes gracias a perfiles terapéuticos mejorados que combaten una variedad de enfermedades y tienen menos efectos secundarios.