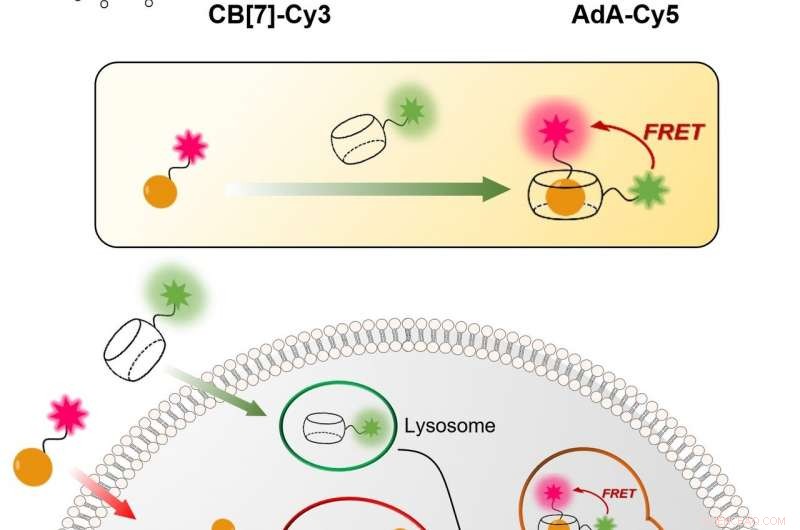
Figura 1:Técnica relativamente simple y económica para visualizar el mecanismo de reciclaje celular (autofagia) en tiempo real. El proceso se basa en la unión entre CB [7] y AdA. CB [7] se une al tinte fluorescente Cy3 (de color verde) y entra en los lisosomas, mientras que el AdA se une al Cy5 fluorescente (de color rojo) que se acumula en las mitocondrias. En el proceso de autofagia, los dos orgánulos celulares se fusionan, conduciendo al encuentro de CB [7] y AdA. Los científicos pueden detectar la fusión, porque cuando los dos tintes fluorescentes se acercan, interactúan entre sí a través del mecanismo de transferencia de energía por resonancia de fluorescencia (FRET). De este modo, el equipo de investigación puede analizar el proceso de autofagia paso a paso. Crédito:Instituto de Ciencias Básicas
Un equipo de investigadores del Centro de Autoensamblaje y Complejidad, dentro del Instituto de Ciencias Básicas (IBS) han observado un proceso fisiológico normal, llamado "comerse a sí mismo", que utilizan las células para reciclar sus componentes. Desarrollaron una técnica precisa que visualiza cómo las mitocondrias, fábricas de energía de las células, están fusionados con lisosomas, máquinas de reciclaje de células, para destruir y reciclar el material. Dado que las irregularidades en este mecanismo pueden conducir a la enfermedad de Alzheimer, Parkinson y otras complicaciones, esta investigación podría ayudar a futuros avances en el diagnóstico de enfermedades degenerativas del cerebro y el desarrollo de fármacos. El estudio fue publicado en Edición internacional Angewandte Chemie .
El nombre "autofagia" proviene del idioma griego y significa "comer a sí mismo". Tan extraño como suena, es un proceso indispensable que se utiliza para limpiar las células de orgánulos y proteínas dañados. Dentro de los lisosomas, las viejas partes celulares se descomponen en sus bloques de construcción, que se emplean para construir otros nuevos. Recientemente, La autofagia se convirtió en un campo de estudio muy activo y estuvo en el centro del Premio Nobel de Fisiología o Medicina de Yoshinori Ohsumi en 2016.
Un ejemplo de orgánulo celular que debe reciclarse periódicamente es la mitocondria. La regulación cuidadosa de este proceso es fundamental, y células que no se dividen con regularidad, como las células nerviosas, son particularmente vulnerables. Si las células acumulan mitocondrias defectuosas, pueden dañarse a sí mismos. Esto ocurre, por ejemplo, en las enfermedades de Alzheimer y Parkinson, donde la acumulación de mitocondrias dañadas y proteínas agregadas conduce a la muerte neuronal.
Se sabe que la autofagia (o mitofagia, en el caso específico de las mitocondrias) ocurre por fusión de dos orgánulos diferentes, en este caso:mitocondrias y lisosomas. Sin embargo, La observación del comportamiento y la fusión de las mitocondrias y los lisosomas dentro de las células ha sido un desafío. Hasta la fecha, la mayoría de estos estudios se basan en proteínas fluorescentes unidas a un orgánulo, lo que permite a los científicos observar solo un orgánulo a la vez. Es más, las propias proteínas fluorescentes se degradan durante la autofagia, lo que dificulta el estudio preciso del mecanismo.
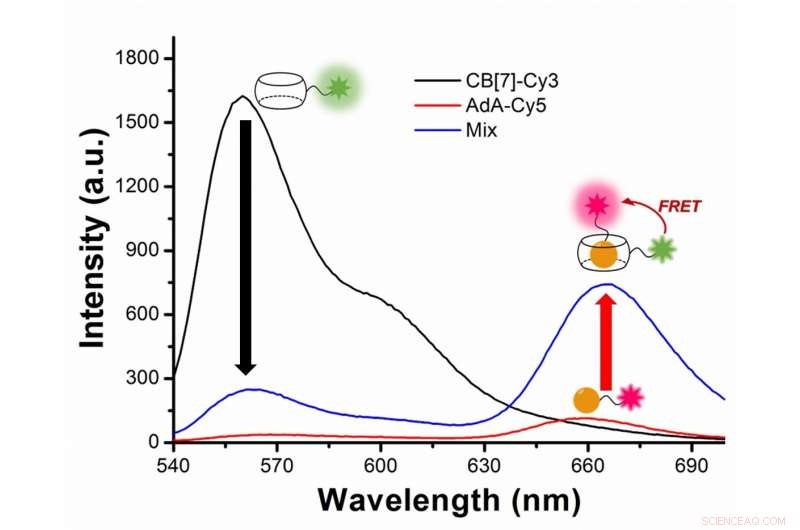
Figura 2:Estudio de la autofagia con transferencia de energía de resonancia de fluorescencia (FRET) entre el tinte fluorescente verdoso Cy3 y el tinte fluorescente rojo Cy5. Cy3 emite fluorescencia con una longitud de onda máxima de 563 nanómetros (línea negra), mientras que Cy5 a 670 nanómetros (línea roja). En el experimento, Cy3 se adjunta a CB [7] y Cy5 a AdA. Durante la autofagia, los dos tintes se acercan y Cy3 transfiere algo de energía a su tinte compañero cercano Cy5, siguiendo el fenómeno FRET. Los científicos capturan el encuentro de los dos tintes como un aumento de la fluorescencia con una longitud de onda de 644-800 nanómetros (línea azul). Crédito:Instituto de Ciencias Básicas
Los científicos del IBS en POSTECH idearon un procedimiento cuantitativo para visualizar tanto las mitocondrias como los lisosomas a lo largo del tiempo. La técnica relativamente simple y económica es más precisa que las actuales. Utiliza moléculas sintéticas huecas en forma de barril, conocido como cucurbituril (CB [7]), que se une con una fuerza de unión excepcionalmente alta a una molécula llamada adamantilamina (AdA) y no puede ser degradada por los lisosomas. CB [7] estaba decorado con un tinte fluorescente (Cy3), mientras que AdA con otro tinte (Cy5). Inicialmente, CB [7] -Cy3 entra en los lisosomas y Ada-Cy5 en las mitocondrias, y luego, cuando los dos orgánulos se fusionan en el proceso de reciclaje, CB [7] -Cy3 y Ada-Cy5 se unen. De este modo, el equipo de investigación siguió el comportamiento de diferentes orgánulos y observó el proceso de mitofagia que ocurre en las células vivas. Es más, los experimentos demostraron que los dos compuestos no son tóxicos para las células por debajo de una dosis de 800 nanomolar.
"La parte más desafiante del experimento fue la elección de los productos químicos. Elegimos los productos químicos con la hidrofilia adecuada, cargar, y tamaño molecular para ser incorporados selectivamente en mitocondrias y lisosomas, "explica PARK Kyeng Min, uno de los autores correspondientes del estudio.
En términos más técnicos, la novedad de este trabajo radica en la aplicación de la transferencia de energía por resonancia de fluorescencia (FRET) al estudio de la autofagia. FRET es una transferencia de energía dependiente de la distancia entre dos tintes fluorescentes diferentes; en este caso Cy3 y Cy5. Cuando los dos estén lo suficientemente cerca, Cy3 dona energía a Cy5. Los científicos capturan el encuentro de los dos tintes, ya que la transferencia de energía de Cy3 a Cy5 conduce a una reducción en la intensidad de fluorescencia de Cy3 a favor de un aumento en la intensidad de emisión de Cy5.
En el futuro, Se podría utilizar una técnica similar para estudiar los procesos de autofagia que involucran a otros orgánulos celulares, como las fábricas de proteínas, el aparato de Golgi y el retículo endoplásmico.