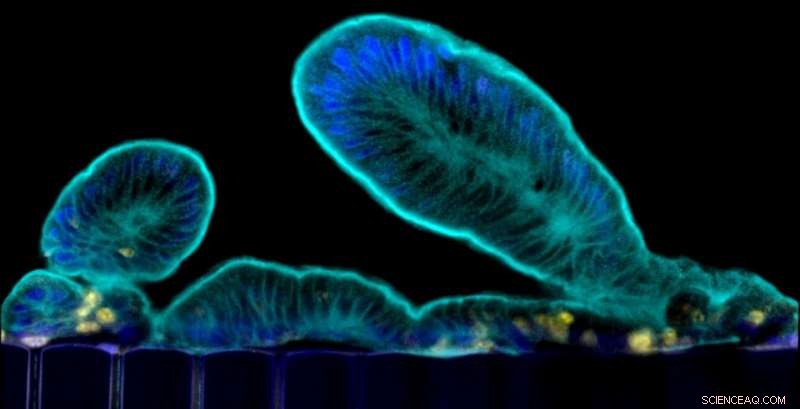
Extensiones parecidas a vellosidades que las células primarias del intestino delgado sobresalen hacia la luz del canal epitelial del chip. Crédito:Instituto Wyss de la Universidad de Harvard
El intestino delgado es el sitio principal donde digerimos y absorbemos nutrientes y minerales de los alimentos. y también es un lugar donde ocurren muchas infecciones intestinales y se manifiestan desórdenes digestivos e inflamatorios. Para comprender mejor el intestino en su estado normal y patológico, Los investigadores han creado "organoides" aislando células madre intestinales de muestras de biopsias humanas. Estos organoides forman todos los tipos de células presentes en el intestino humano, pero crecen como quistes rodeados por geles gruesos de matriz extracelular con su superficie celular "apical" (que normalmente está expuesta al contenido del intestino) mirando hacia un lumen cerrado. Esto evita el estudio de procesos dinámicos que involucran la barrera intestinal, incluido el transporte de nutrientes y medicamentos, así como sus interacciones con el microbioma. Además, los organoides carecen de vasculatura y los movimientos mecánicos causados por la peristalsis normal y el flujo sanguíneo, que son vitales para muchos procesos en el intestino, incluyendo su regeneración y control del sobrecrecimiento bacteriano.
En un esfuerzo por superar estas limitaciones, un equipo en el Instituto Wyss de Ingeniería de Inspiración Biológica dirigido por su Director Fundador, Donald Ingber, MARYLAND., Doctor., había diseñado previamente un dispositivo de cultivo de microfluidos "Organ-on-a-Chip" (Organ Chip) en el que se cultivaron células de una línea celular intestinal humana originalmente aislada de un tumor en uno de dos canales paralelos, separados por una membrana recubierta de matriz porosa de células endoteliales derivadas de vasos sanguíneos humanos en el canal adyacente. Aunque este chip de intestino humano recreó el epitelio de las vellosidades del intestino normal y permitió nuevos conocimientos sobre cómo el flujo y la peristalsis cíclica afectan la diferenciación y función intestinal, no se podía utilizar para estudiar procesos que dependían de células intestinales normales de donantes individuales, cuales, por ejemplo, es fundamental para estudiar las respuestas específicas del paciente para la medicina personalizada.
En un nuevo estudio, publicado en Informes científicos , El equipo de Ingber ahora elimina estos obstáculos. "Ahora podemos aprovechar el enfoque organoide para aislar células madre intestinales de biopsias humanas, pero rompemos los organoides y cultivamos las células específicas del paciente dentro de nuestros Organ Chips, donde forman espontáneamente vellosidades intestinales orientadas hacia la luz del canal, y el epitelio en aposición cercana al endotelio microvascular intestinal humano, "dijo Ingber, quien también es el Profesor Judah Folkman de Biología Vascular en la Escuela de Medicina de Harvard (HMS) y el Programa de Biología Vascular en el Boston Children's Hospital, así como profesor de Bioingeniería en la Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson de Harvard (SEAS). "Este enfoque presenta un nuevo trampolín para la investigación de procesos normales y relacionados con enfermedades de una manera altamente personalizada, incluido el transporte de nutrientes, digestión, diferentes trastornos intestinales, e interacciones intestinales con microbios comensales y patógenos ".
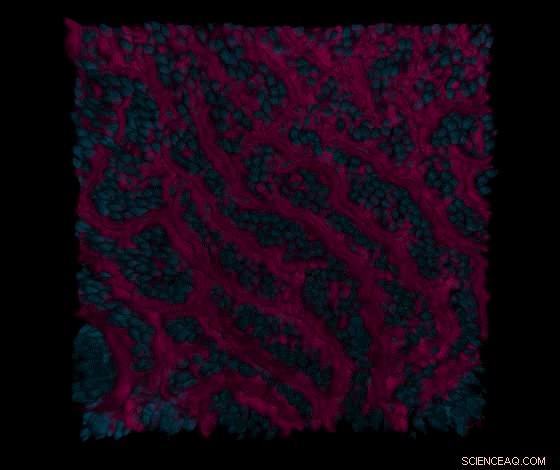
Una serie de secciones de microscopía confocal tomadas a través del epitelio intestinal y los canales vasculares del intestino delgado primario en un chip visualiza primero la superficie de las estructuras epiteliales similares a vellosidades (en rojo) y los núcleos (en azul) de las células epiteliales del intestino delgado en el canal intestinal, y luego contactos célula-célula (en verde) de células endoteliales intestinales en el canal vascular adyacente. Crédito:Instituto Wyss de la Universidad de Harvard
El equipo colaboró con el laboratorio de David Breault en el Boston Children's Hospital para incorporar un paso de cultivo de organoides en su procedimiento para aislar las células madre intestinales normales y aumentar su número de células. Los organoides resultantes podrían almacenarse para uso futuro o fragmentarse y sembrarse inmediatamente en los canales "epiteliales" de múltiples chips de órganos, donde se maduraron aún más mediante el flujo de medio de cultivo especializado y la aplicación de estimulación mecánica a los canales para imitar movimientos fisiológicos similares a la peristalsis. La maduración del epitelio en un epitelio intestinal de vellosidades con extensiones largas en forma de dedos fue ayudada por el cultivo conjunto de células endoteliales microvasculares intestinales humanas en el lado opuesto de la membrana porosa recubierta de matriz compartida en el canal "vascular" donde ensamblaron una sangre sustituta. recipiente con un lumen hueco a través del cual fluía el medio de alimentación.
Por lo tanto, combinando dos de las tecnologías más avanzadas en el campo de la ingeniería de tejidos? cultivo organoide y chips de órganos? permitió la generación de tejidos intestinales y estructuras a nivel de órganos revestidas por células específicas de donantes humanos con morfología, composición, y su función se parece mucho a la de la región duodenal del intestino delgado normal. "Debido a que el chip primario del intestino delgado recapitula el microambiente físico que experimentan las células dentro del cuerpo humano, como el flujo de fluido y los movimientos de estiramiento cíclicos similares a la peristalsis, exhibe un perfil de expresión génica en todo el genoma que se acerca más a su contraparte in vivo que al de las mismas células intestinales cultivadas como organoides 3D, "dijo la primera autora Magdalena Kasendra, Doctor., un ex becario postdoctoral en el equipo de Ingber y ahora científico principal en Emulate, Inc. en Boston.
Junto con las células madre intestinales, el equipo identificó enterocitos diferenciados que digieren y absorben nutrientes, células caliciformes productoras de moco, células enteroendocrinas secretoras de hormonas, y células de Paneth que regulan y detectan el microbioma, y realizaron una serie de ensayos que confirmaron sus funciones. Como el microambiente del intestino delgado se puede mantener durante semanas en chips de órganos perfundidos continuamente, permiten estudios tanto a corto como a largo plazo cuyas observaciones pueden relacionarse con la salud y fisiología de los donantes individuales.
El equipo de Ingber está aplicando el mismo enfoque ahora a diferentes regiones del intestino:duodeno, yeyuno, íleon, y colon, cuyas funciones y vulnerabilidades a las enfermedades difieren entre sí. Este enfoque también se está utilizando para realizar ingeniería inversa en entornos intestinales aún más complejos mediante la integración de otros tipos de células, como las células inmunes, células neuronales, y microbios comensales en el dispositivo. "En el futuro, Tales esfuerzos podrían permitirnos comprender mucho mejor las interacciones humano-microbioma, modelo de trastornos de desnutrición y enfermedades inflamatorias del intestino, y realizar pruebas de drogas personalizadas, "dijo el co-primer autor Alessio Tovaglieri, estudiante de posgrado en el Departamento de Ciencia y Tecnología de la Salud de ETH Zurich en Suiza, quien realiza su trabajo de tesis en el equipo de Ingber.