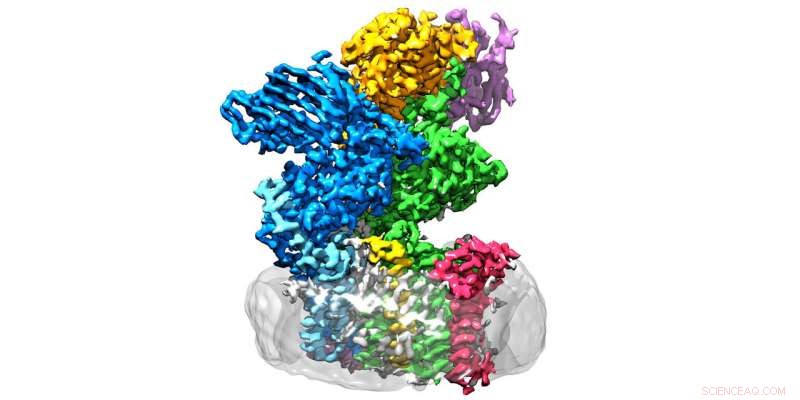
La enzima oligosacariltransferasa se encuentra en la membrana (gris) y consta de ocho subunidades. Crédito:Julia Kowal / ETH Zurich
Los investigadores de ETH han logrado determinar la estructura tridimensional de la enzima que une las cadenas de azúcar a las proteínas, un avance que publicaron recientemente en la revista. Ciencias .
Siempre que las células reciben señales, interactuar con otras células o identificar virus y bacterias, el proceso involucra no solo proteínas sino también cadenas de azúcar adheridas a su superficie. El tema de relativamente poca atención hasta ahora, estas estructuras difieren ampliamente en composición y ramificación, y parecen ayudar a garantizar que las proteínas se plieguen correctamente y puedan realizar sus tareas específicas.
Varias observaciones demuestran la importancia de los apéndices azucarados:proteínas idénticas con diferentes cadenas de azúcar tienen diferentes funciones, las células enfermas y sanas tienen diferentes composiciones de azúcar en sus superficies, y las drogas a las que están adheridas aparentemente se toleran mejor.
¿Cómo llega el azúcar a la proteína?
Conocidos como glucanos, estas sustancias son actualmente objeto de una intensa investigación. Después de la genómica y la proteómica, ahora también hay glicómicos. El campo de investigación emergente de la glicobiología se ocupa de la biosíntesis, estructura y las diversas funciones de los apéndices azucarados. Una pregunta clave es cómo el diverso conjunto de moléculas de azúcar llega a las proteínas en primer lugar.

Imágenes de microscopio crioelectrónico de la enzima. Crédito:Rebekka Wild / ETH Zurich
Los investigadores de ETH de los grupos liderados por Kaspar Locher del Instituto de Biología Molecular y Biofísica y Markus Aebi del Instituto de Microbiología han dado un paso adelante decisivo en esta área:han determinado la estructura tridimensional de la oligosacariltransferasa (OST) en levadura. "Esta es la enzima que conecta las proteínas con los árboles de azúcar, "explica Rebekka Wild, uno de los tres autores principales del informe en Ciencias en el que los investigadores de ETH presentan sus hallazgos.
Determinar la estructura de OST no fue fácil:para empezar, Jilliane Eyring, el tercer autor principal del informe, modificó las células de levadura para que la enzima pudiera ser dirigida y purificada. Wild primero tuvo que extraer la enzima, que está incrustado en una membrana en la célula, a partir de grandes cantidades de estas células de levadura y luego purificarlas en un laborioso procedimiento. "Nueve litros de levadura produjeron alrededor de 0,2 miligramos de enzima, ", dice. Las moléculas OST se aplicaron a una pequeña cuadrícula, flash-congelado como individuo, separar las partículas y obtener imágenes utilizando un microscopio crioelectrónico de alta resolución.
Esto dio lugar a miles de imágenes que mostraban el complejo enzimático desde todos los ángulos de visión posibles. De estas imágenes, Julia Kowal, el segundo autor principal, generó la estructura tridimensional de OST. Se necesitaron seis semanas para realizar los cálculos en el grupo de computadoras. El resultado fue un mapa de densidad de electrones que muestra la enzima como una "nube de electrones".
"Aprovechamos un momento de suerte, "Wild explica. Pudieron beneficiarse de la" revolución de la resolución "que está teniendo lugar actualmente en la microscopía crioelectrónica y utilizar un dispositivo de última generación con resolución atómica. El desarrollo de esta tecnología fue galardonado con el Premio Nobel en Química en 2017.
Para interpretar los datos de microscopía electrónica, Wild tuvo que ajustar la secuencia de aminoácidos de OST "manualmente" en las pequeñas nubes en el mapa tridimensional. Por lo tanto, el investigador pudo representar la estructura 3-D de OST con todo detalle, un avance que fue recibido con agrado entre los investigadores después de su publicación en línea.
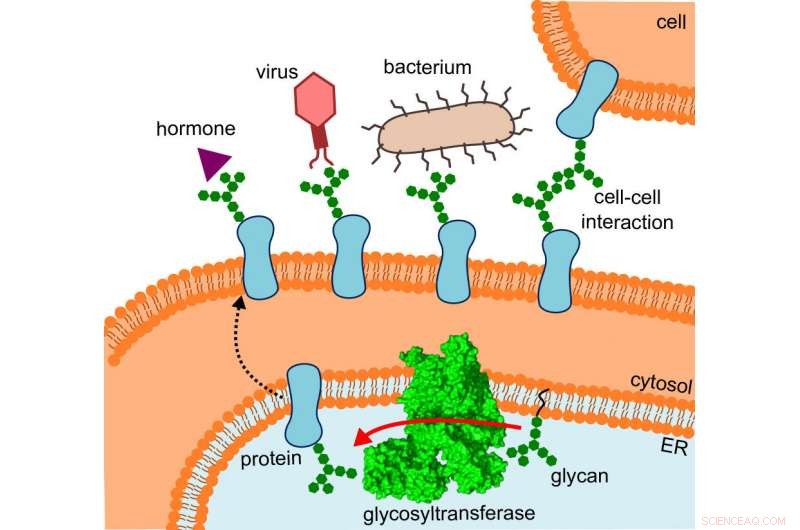
El diagrama muestra dónde se encuentra la glicosiltransferasa, la ruta que toman las proteínas alteradas y las interacciones que experimentan. Crédito:R. Wild / ETH Zurich
OST es un complejo de proteínas de membrana formado por ocho subunidades, que identifican, por ejemplo, los sustratos de azúcar o proteína o estabilizar la unidad catalítica. Este último es la subunidad de la enzima que alberga el centro activo, donde las proteínas y los azúcares se unen y fusionan. "Esperábamos que la unidad catalítica estuviera en el medio de la enzima, "Wild explica". Sorprendentemente, sin embargo, está en el exterior y la forma recuerda a una boca bien abierta ".
Lo que inicialmente había confundido a los investigadores de repente tuvo sentido, ya que encajaron la estructura en la ubicación donde OST realmente opera:específicamente, la enzima está incrustada in vivo en la membrana del retículo endoplásmico (RE). Esta es la parte de la célula donde se producen las proteínas, doblada, monitoreado y modificado.
Aquí, el vecino directo de la OST es una proteína túnel, eso ya se sabía. Esto canaliza las proteínas incipientes hacia el interior del retículo endoplásmico y luego directamente hacia la boca abierta del OST, donde reciben sus diminutos árboles de azúcar.
"La levadura OST es un buen modelo para los procesos en humanos, "Wild explica. Los investigadores extraen esta conclusión del hecho de que el centro activo de la levadura OST, donde las proteínas están equipadas con azúcares, se parece mucho al área correspondiente en bacterias. "Esto significa que el centro activo apenas ha cambiado a lo largo de la evolución, "explica el investigador, "lo que significa que es muy probable que siga funcionando de forma muy similar en los mamíferos, y por lo tanto también en humanos ".