
Estructura química completa del receptor de dopamina 2 unido al fármaco antipsicótico risperidona. Crédito:Laboratorio Roth, Facultad de Medicina de la UNC
Aunque los fármacos antipsicóticos se encuentran entre los medicamentos más recetados, individuos con esquizofrenia, El trastorno bipolar y los trastornos del espectro autista a menudo experimentan efectos secundarios graves porque los medicamentos interactúan con docenas de otros receptores cerebrales. Ahora, Científicos de la Facultad de Medicina de la UNC y UC San Francisco (UCSF) han resuelto la primera estructura cristalina de alta resolución del receptor de dopamina 2 (DRD2) unido al fármaco antipsicótico risperidona. produciendo una herramienta largamente esperada para los desarrolladores de fármacos, psiquiatras, y neurocientíficos.
La investigación, publicado en Naturaleza , permitirá a los investigadores activar selectivamente DRD2, limitando así potencialmente una serie de efectos secundarios graves de los fármacos antipsicóticos, como el aumento de peso, ansiedad, mareo, problemas digestivos graves, agitación, y muchos otros.
"Si queremos crear mejores medicamentos, el primer paso es ver cómo se ve el receptor D2 con detalles de alta resolución cuando está estrechamente ligado a un fármaco, "dijo el autor principal Bryan L. Roth, MARYLAND, Doctor, el Profesor Distinguido Michael Hooker de Terapéutica de Proteínas y Proteómica Traslacional en la Facultad de Medicina de la UNC. "Ahora tenemos la estructura, y lo estamos explorando para encontrar nuevos compuestos que esperamos puedan ayudar a millones de personas que necesitan mejores tratamientos ".
Aproximadamente el 30 por ciento de los medicamentos en el mercado activan los receptores acoplados a la proteína G en las superficies celulares y desencadenan señales químicas dentro de las células para producir sus efectos terapéuticos. Para medicamentos antipsicóticos, un efecto es aliviar los síntomas psicóticos asociados con la esquizofrenia, trastorno bipolar y muchas otras enfermedades psiquiátricas. Desafortunadamente, debido a que los científicos no han entendido las diferencias estructurales entre los diferentes tipos de receptores del cerebro, la mayoría de los fármacos no pueden diseñarse para dirigirse a un solo tipo de receptor; interactúan no solo con DRD2, pero una miríada de otras dopaminas, serotonina histamina y receptores alfa adrenérgicos, dando lugar a efectos secundarios graves.
DRD2 ha sido objeto de un estudio exhaustivo durante 30 años, pero hasta ahora los investigadores carecían de una estructura de alta resolución de DRD2 adherida a un compuesto. La risperidona es un medicamento antipsicótico comúnmente recetado que está aprobado por la FDA para su uso en la esquizofrenia. trastorno bipolar, y trastorno del espectro autista. La risperidona es también uno de los pocos fármacos antipsicóticos "atípicos" aprobados para su uso en niños.
"Con esta estructura de alta resolución en la mano, anticipamos el descubrimiento de compuestos que interactúan con DRD2 de formas específicas importantes para mayores acciones terapéuticas y menos efectos secundarios, "Dijo Roth.
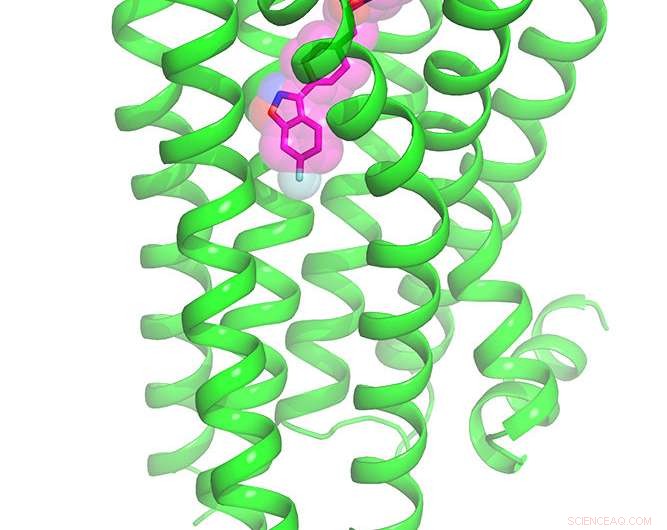
Ilustración del receptor de dopamina 2 unido al fármaco antipsicótico risperidona. Crédito:Laboratorio Roth, Facultad de Medicina de la UNC
Normalmente, los científicos han resuelto la estructura química de las proteínas mediante una técnica llamada cristalografía de rayos X. Usan enfoques experimentales para inducir a la proteína a condensarse en una red cristalina compacta, luego dispara rayos X al cristal, y finalmente calcular la estructura de la proteína a partir de los patrones de difracción resultantes. Sin embargo, conseguir que la proteína DRD2 cristalizara con un fármaco unido a ella había sido imposible durante décadas porque los receptores son proteínas notoriamente volubles:pequeñas, frágil, y típicamente en movimiento cuando se unen a compuestos.
Para trascender los desafíos técnicos, Colegas de Roth y UNC, incluidos los becarios postdoctorales Sheng Wang, Doctor, y Daniel Wacker, Doctor, llevó a cabo una serie de estudios minuciosos durante varios años, descritos en el Naturaleza papel:para convencer a DRD2 de que cristalice mientras se une firmemente a la risperidona.
Una vez que tuvieron la imagen de alta resolución, pudieron ver que la risperidona se une a DRD2 de una manera completamente inesperada. Más modelos computacionales realizados por los investigadores de UCSF Brian Shoichet, Doctor, y Anat Levit, Doctor, reveló que el modo de unión de la risperidona era impredecible:había un bolsillo nunca antes visto en el receptor que Roth y sus colegas creen que podría ser el objetivo para crear medicamentos más selectivos.
"Ahora que podemos ver las diferencias estructurales entre receptores similares, como el receptor de dopamina D4 y DRD2, podemos imaginar nuevos métodos para crear compuestos que solo se unan a DRD2 sin interactuar con docenas de otros receptores cerebrales ", dijo Wacker, coautor correspondiente del estudio. "Este es precisamente el tipo de información que necesitamos para crear terapias más seguras y efectivas".
Los efectos adversos de los fármacos antipsicóticos incluyen síntomas extrapiramidales, como el movimiento muscular involuntario parkinsoniano. Wang dijo:"Ahora que hemos resuelto la estructura de la risperidona unida a DRD2, nos estamos haciendo una idea de cómo se podrían evitar estos efectos secundarios ".
Roth agregó, "Antes de venir a UNC, Yo era psiquiatra especializado en el tratamiento de la esquizofrenia. Diariamente, estaba claro para mí que los medicamentos solo eran moderadamente efectivos para un gran número de pacientes. Nuestra falta de conocimiento sobre cómo los medicamentos antipsicóticos se unen a sus receptores ha frenado el progreso hacia la creación de medicamentos más efectivos. Resolver la estructura cristalina de alta resolución de DRD2 unido al fármaco antipsicótico comúnmente recetado risperidona es el primer paso hacia la creación de medicamentos más seguros y efectivos para la esquizofrenia y trastornos relacionados ".