Los implantes dentales son cada vez más comunes como sustitutos de los dientes en Noruega. El reemplazo no siempre viene sin problemas, sin embargo. Crédito:Colourbox.com
Las moléculas que se conocen con más frecuencia por su potencial de causar cáncer pueden tener un nuevo papel promotor de la salud. Los científicos ahora están descubriendo cómo se pueden utilizar estos "radicales" para prevenir infecciones y promover el éxito a largo plazo de los implantes dentales.
Aunque los dentistas recomiendan que conservemos nuestros propios dientes el mayor tiempo posible, cada vez más muchos de nosotros eventualmente necesitaremos uno o más dientes reemplazados con implantes de titanio. Esto es especialmente cierto para las generaciones mayores.
Sin embargo, Los implantes dentales a menudo demuestran ser solo un reemplazo parcialmente exitoso. Las bacterias pueden colonizar el área alrededor de un implante. Las infecciones bacterianas alrededor de un implante pueden, en última instancia, provocar la pérdida del hueso que sostiene el implante. dejando al paciente con una gran necesidad de un tratamiento extenso y, como resultado, una salud bucal más pobre en general.
Si el hueso alrededor de un implante se infecta, Existe un riesgo grave de que el paciente necesite un tratamiento y un mantenimiento dentales restauradores completos para mantener la función del implante y restaurar el hueso perdido. si es posible en absoluto. Como consecuencia, La investigación de biomateriales que se pueden utilizar para aumentar y guiar el recrecimiento del hueso perdido se ha convertido en un área líder de la investigación dental.
Biofilms sobre implantes
Para que un implante dental funcione, debe estar firmemente sujeto a la mandíbula. Esto significa que las células óseas necesitan vencer a las bacterias en la llamada "carrera por la superficie" del implante. Al ganar la carrera, las células óseas formarán tejido óseo nuevo alrededor del implante, uniendo el implante al hueso.
Sin embargo, a menudo son las bacterias las que ganan la carrera. Forman una biopelícula, una fina capa de bacterias en la superficie del implante. - El biofilm es una forma inteligente de que las bacterias colonicen las superficies; hace que las bacterias sean más fuertes, explica David Wiedmer, investigador de la Facultad de Odontología de la Universidad de Oslo. Si las bacterias dominan la superficie del implante, el implante es propenso a infecciones, con consecuencias potencialmente graves para la salud del paciente.
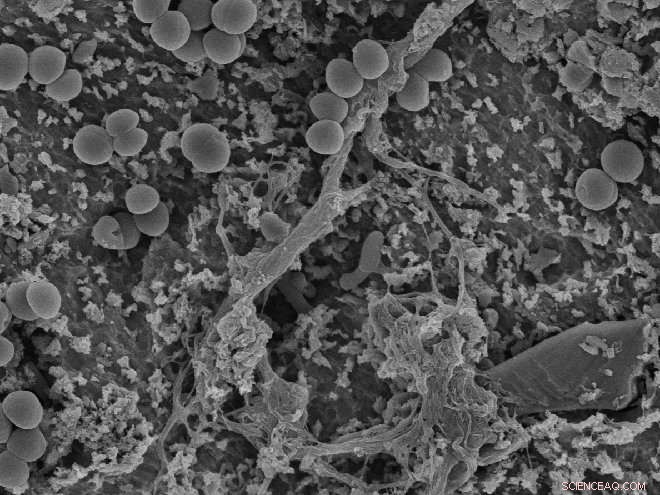
Las bacterias ganaron la carrera para conquistar la superficie:los «puntos» circulares son bacterias que se han adherido a la superficie de un implante. Los ensayos de Wiedmer mostraron que las moléculas de radicales pueden contribuir a alterar las bacterias y causar un efecto antibacteriano. Crédito:OD, UiO / David Wiedmer
Los implantes infectados generalmente se tratan con antibióticos. - Cuando las bacterias forman una biopelícula, los antibióticos a menudo no funcionan porque las bacterias están protegidas dentro de una biopelícula. A la luz del dramático aumento de bacterias resistentes a los antibióticos, hay una necesidad urgente de encontrar tratamientos alternativos, dice Wiedmer, quien es originalmente un ingeniero mecánico. Comenzó a considerar los radicales libres como alternativa. Estas moléculas inestables pueden causar estrés en las bacterias, que a su vez puede crear un efecto antibacteriano.
Moléculas de radicales altamente reactivas
Los radicales libres son moléculas inestables porque tienen un electrón desapareado. Por lo tanto, siempre están buscando otro electrón con el que emparejarse. Se sabe que los radicales libres son moléculas dañinas y patógenas que pueden causar cambios en el ADN, que a su vez puede crear mutaciones que pueden conducir al cáncer. La hipótesis de Wiedmer era que la reactividad de los radicales libres también podría usarse para matar bacterias.
Basó su idea en un proceso químico conocido, fotocatálisis:cuando el dióxido de titanio (TiO2) se expone a la luz ultravioleta, como se encuentra en la luz del sol, en presencia de oxígeno, la superficie se limpia de cualquier suciedad orgánica, descomponiéndolo en agua y oxígeno. Este proceso de limpieza se basa en la formación de radicales libres y es la misma reacción que se utiliza en las células solares para producir energía.
Los implantes dentales también tienen TiO2 en su superficie. Casi todos los implantes dentales están hechos de titanio, y el TiO2 se crea cuando el titanio entra en contacto con el oxígeno del aire o la sangre, p.ej. cuando se inserta un implante en la boca.
Catálisis oscura para el tratamiento y la prevención.
Sin embargo, es difícil producir reacciones fotocatalíticas sobre implantes. Esto se debe al problema obvio de agregar la luz solar necesaria a la reacción entre el TiO2 en la superficie del implante y el oxígeno en la sangre cuando el implante ya está insertado en el hueso de la mandíbula.

Al investigar la rapidez con la que la solución química perdió su color azul, El candidato a doctorado David Wiedmer pudo detectar qué tipos de dióxido de titanio (TiO2) contribuían a que las bacterias no establecieran una biopelícula en los implantes. Crédito:OD, UiO / Margit Selsjord
Por esta razón, Wiedmer ha estudiado el tratamiento de infecciones bacterianas en implantes utilizando un método que él llama "catálisis oscura". Al combinar TiO y peróxido de hidrógeno (H2O2), en lugar de agua y luz solar, logra un efecto similar al de la fotocatálisis. Cuando se agrega H2O2 a un implante cubierto por una capa de TiO2, también se liberan radicales libres, pero esta vez en la oscuridad.
Dadas las fuertes propiedades antibacterianas de los radicales libres producidos, Wiedmer investigó la catálisis oscura en TiO2 en dos aplicaciones biomédicas diferentes. La primera aplicación probada fue para tratar una infección existente alrededor de un implante. Su investigación también examinó si el método podría tener un efecto preventivo en "andamios", estructuras porosas que se pueden insertar en la mandíbula para apoyar y guiar a las células óseas para que crezcan y formen hueso "nuevo".
Prometedor, pero difícil de implementar
Wiedmer tiene motivos para ser optimista de que algún día será posible controlar las infecciones bacterianas alrededor de los implantes dentales y prevenirlas más fácilmente. Sus estudios demostraron que la catálisis oscura es un método prometedor para tratar infecciones, ya que crea radicales que ayudan a combatir las bacterias.
La investigación también indicó que la catálisis oscura podría desarrollarse más y aplicarse a los armazones óseos. Estos andamios apoyan la regeneración del tejido óseo perdido en el que luego se pueden insertar implantes. En sus estudios, Wiedmer descubrió que los radicales formados por catálisis oscura podían evitar que las bacterias colonizaran la superficie de los andamios porosos de TiO2.
"El efecto preventivo es en realidad más importante que su uso en el tratamiento de infecciones preexistentes. Después de todo, Los implantes que causan problemas debido a infecciones pueden, como último recurso, ser extraído. Pero no se puede quitar fácilmente un andamio poroso una vez que el hueso ya ha crecido en los poros del andamio, " el explica.
Sin embargo, Hay mucha más investigación por hacer antes de que se pueda aplicar la catálisis oscura en las cirugías dentales. Wiedmer no pudo descartar de manera concluyente la posibilidad de que los radicales también dañen el ADN celular mientras luchan contra las bacterias. - Espero que esta nueva estrategia de usar radicales libres para matar bacterias pueda ayudarnos a encontrar tratamientos alternativos a los antibióticos. Aunque todavía queda camino por recorrer, incluidos los ensayos clínicos, este proyecto podría eventualmente arrojar algo más de luz en la oscuridad, Wiedmer dice con una sonrisa.