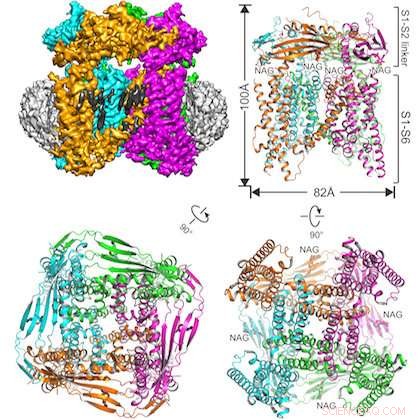
La ilustración muestra la proteína estudiada incrustada en una estructura de nanodisco (arriba a la izquierda) y tres vistas del canal iónico TRPML1 desde diferentes ángulos. Crédito:UT Southwestern
Los investigadores del UT Southwestern Medical Center publicaron hoy una estructura atómica tridimensional del canal iónico que se encuentra en los mamíferos y que está implicada en una rara, enfermedad neurodegenerativa hereditaria en humanos. El trabajo marca la primera estructura de este tipo determinada utilizando la instalación de microscopía crioelectrónica (cryo-EM) de la universidad que se inauguró el año pasado.
En crio-EM, las muestras se congelan rápidamente para evitar la formación de cristales de hielo dañinos y luego se ven a menos 321 grados Fahrenheit (temperaturas criogénicas). La instalación de UT Southwestern, que funciona las 24 horas del día, es una de las mejores instalaciones del mundo para la biología estructural de crio-EM.
El equipo interdisciplinario resolvió la estructura del canal iónico de ratón TRPML1 (potencial receptor transitorio mucolipina 1).
Su estudio, publicado en línea por Naturaleza , llega apenas una semana después de que tres desarrolladores de tecnología crio-EM fueran reconocidos con el Premio Nobel de Química 2017 por su trabajo en los instrumentos y metodologías que desencadenaron la "revolución de la resolución". Cryo-EM permite vistas a nivel atómico de proteínas que resisten la cristalización necesaria para la cristalografía de rayos X tradicional.
"Los canales iónicos en funcionamiento son necesarios para el movimiento adecuado de partículas cargadas eléctricamente (iones) dentro y fuera de las células y orgánulos para ejecutar los procesos celulares, "dijo el Dr. Youxing Jiang, Catedrático de Fisiología y Biofísica, investigador del Instituto Médico Howard Hughes (HHMI), y coautor correspondiente del estudio.
El canal TRPML1, que regula el flujo de iones de calcio, se encuentra en todos los mamíferos. El canal se encuentra en la membrana de orgánulos dentro de células llamadas lisosomas, que contienen enzimas que ayudan en el reciclaje celular al descomponer moléculas grandes.
Se han identificado alrededor de 50 enfermedades de almacenamiento lisosómico (LSD) en humanos, incluida una clase de LSD causada por mutaciones de pérdida de función en los genes que gobiernan los canales TRPML1. Este LSD llamada mucolipidosis tipo IV, se caracteriza por un retraso en el desarrollo de las habilidades mentales y motoras y una discapacidad visual, según los Institutos Nacionales de Salud.
"Debido a su vínculo con esa clase de enfermedades de almacenamiento lisosómico, TRPML1 ha sido un objetivo potencial para terapias de moléculas pequeñas y se han desarrollado varios agonistas potenciales (abridores de canales), "dijo el Dr. Jiang, oooh. Caruth, Jr. Scholar en Investigación Biomédica. La determinación de la estructura de TRPML1 podría ayudar en la búsqueda de tratamientos para la mucolipidosis tipo IV, él dijo.
La instalación de crio-EM de UT Southwestern alberga tres instrumentos de alta tecnología, incluyendo una altura de 12½ pies, Titan Krios de 2 toneladas que dispara un rayo de alta potencia a través de cada muestra mientras una cámara especial captura imágenes de los electrones dispersos que resultan. Un brazo robótico dentro de la máquina puede sostener y mover con precisión una docena de muestras congeladas instantáneamente de manera automatizada para que se puedan grabar miles de imágenes. procesado a través de computadoras, e interpretado para generar imágenes en 3-D para su estudio, explicaron los investigadores.

El equipo de investigación de UTSW que determinó la estructura atómica tridimensional de un canal de iones incluye (fila inferior, desde la izquierda) los Dres. Youxing Jiang y Xiaochen Bai, y (fila superior, desde la izquierda) Jiangtao Guo, Quingfeng Chen, Weizhong Zeng, y Ji She. Crédito:UT Southwestern
Otra distinción en este estudio es el uso exitoso de una técnica de preparación de muestras relativamente nueva:incrustar la proteína de interés en una estructura de nanodiscos hecha de lípidos y otros materiales biológicos. El autor principal, el Dr. Qingfeng Chen, un investigador postdoctoral en el laboratorio de Jiang, creó la muestra.
"Por mucho tiempo, Se ha utilizado detergente para extraer proteínas de las membranas para su estudio. La gente ha sugerido que el detergente podría cambiar la estructura de la proteína de su estado nativo, "dijo el Dr. Xiaochen Bai, profesor asistente de biofísica y biología celular y segundo autor correspondiente del estudio. "Proteínas de membrana, como los que estudiamos, suelen estar envueltos en lípidos. Los nanodiscos se utilizan para proporcionar un entorno nativo para la muestra de proteína ".
El Dr. Bai se especializa en el software sofisticado que se utiliza para revelar la organización de los átomos individuales dentro de cada partícula. Fue reclutado para UT Southwestern como becario del Instituto de Investigación y Prevención del Cáncer de Texas (CPRIT) y becario de Virginia Murchison Linthicum en Investigación Médica después de cinco años de capacitación en el Laboratorio de Biología Molecular MRC en Cambridge. REINO UNIDO.
Trabajando en un equipo que desarrolla lo que se ha convertido en uno de los mejores programas de software para procesar los datos de imagen generados por la microscopía electrónica, El Dr. Bai tuvo muchas conversaciones con el Dr. Richard Henderson, uno de los tres científicos galardonados con el Premio Nobel de Química la semana pasada.
“Pasó día y noche en el laboratorio trabajando en el desarrollo de métodos para crio-EM. Una de sus grandes contribuciones fue el desarrollo de un nuevo tipo de cámara para tomar mejores fotografías de las proteínas estudiadas con crio-EM, "Dijo el Dr. Bai." Cuando me mudé por primera vez a Inglaterra, me brindó mucha orientación y apoyo y tuvimos muchas discusiones sobre técnicas de crio-EM ".