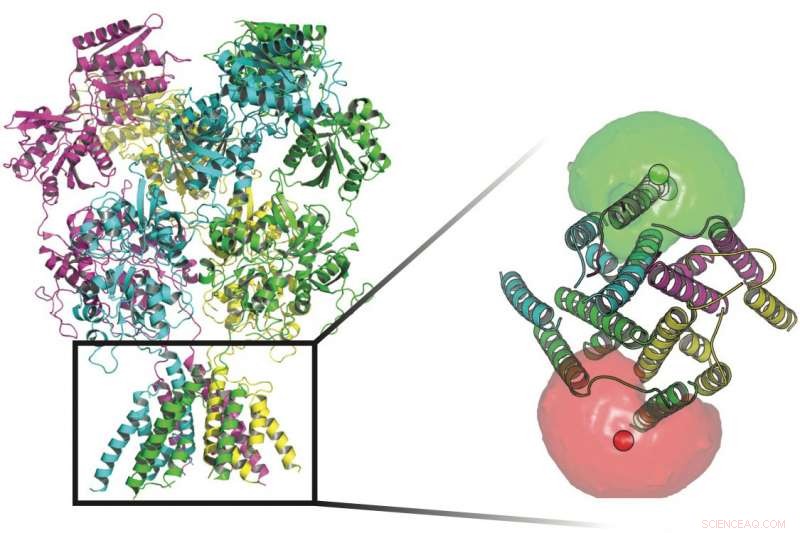
Los científicos de la Universidad de Rice y UTHealth rastrearon las conformaciones de proteínas que vigilan los canales transmembrana en las paredes de las células nerviosas. En la base de las proteínas en esta imagen hay fluoróforos (esferas rojas y verdes) rodeadas por nubes de fluoróforos que ayudaron a los investigadores a definir los movimientos de la puerta que permite que los iones fluyan a través de la membrana. Crédito:Universidad Rice / UTHealth
La capacidad de rastrear los movimientos de moléculas individuales ha revelado cómo las proteínas en la superficie de las células nerviosas controlan las puertas que convierten las señales químicas en señales eléctricas. El hallazgo es un paso adelante en el detalle de los mecanismos involucrados en la enfermedad neurológica, según investigadores de la Universidad Rice y el Centro de Ciencias de la Salud de la Universidad de Texas en Houston (UTHealth).
Utilizando sofisticados métodos estadísticos y de imágenes, Los científicos emplearon técnicas de imagen FRET de molécula única para establecer una cabeza de playa en la puerta del receptor NMDA que, cuando se activa, permite que los iones fluyan a través de la membrana de la célula nerviosa.
FRET significa transferencia de energía de resonancia de Förster. Es una forma de utilizar la luz emitida por dos moléculas marcadas con fluorescencia como una regla sensible para distancias muy pequeñas. como la apertura en el canal del receptor NMDA.
La química arrocera Christy Landes, un experto en FRET de una sola molécula, y Vasanthi Jayaraman, profesor de bioquímica y biología molecular en la Facultad de Medicina McGovern de UTHealth, cuya experiencia está en la bioquímica del receptor NMDA, se unieron para recopilar la primera evidencia experimental que detalla la dinámica de cómo los receptores alteran sus formas para controlar la sensibilidad de la puerta a las señales químicas. El nuevo estudio aparece en Biología química de la naturaleza .
El receptor de NMDA se compone de cuatro subunidades de proteínas, cada uno con cuatro dominios, y cada uno de esos dominios tiene una función particular. Colectivamente, atraviesan la membrana celular. Cada subunidad puede tener muchos "estados, "o formas, que regulan qué señales eléctricas (y cuántas de ellas) pasan. Las subunidades se encuentran a cada lado del canal y se activan cuando se unen a ligandos neurotransmisores de glutamato y glicina y activan la vía de señalización que permite que los iones cargados positivamente pasen a la célula.
"Estos receptores son fundamentales para la función fisiológica normal, ", Dijo Jayaraman." Muchas veces es posible que no desee encender o apagar la señalización. Es posible que desee marcar el alcance de la señalización. Una vez que entendemos todos los estados de la proteína, podemos empezar a pensar en formas de hacer esto, manteniendo así la proteína activa pero en diversos grados según sea necesario.
"Es importante para el desarrollo de fármacos comprender estas dinámicas porque los movimientos y las propiedades energéticas de estas proteínas dictan sus funciones específicas, ", dijo." Pudimos hacer ambas cosas ".
Este conocimiento podría conducir a fármacos multifuncionales que influyan en los canales de forma sutil, Landes dijo. Los antagonistas del receptor NMDA conocidos incluyen anestésicos comunes, opioides sintéticos como la metadona y drogas disociativas como la ketamina y el óxido nitroso. Se sospecha una función deprimida del receptor de NMDA en los déficits de memoria comúnmente asociados con el envejecimiento. Se sabe que el alcohol inhibe el glutamato, uno de los dos neurotransmisores que se unen al NMDA.

Las cuatro subunidades de las proteínas receptoras de NMDA pueden tener cada una muchos estados que regulan qué señales eléctricas pasan a través de la membrana de una célula nerviosa. Las subunidades se activan cuando se unen a ligandos neurotransmisores de glutamato y glicina y activan la vía de señalización que permite que los iones cargados positivamente pasen a la célula. Crédito:Universidad Rice / UTHealth
"Gran parte del diseño de fármacos tiene como principio fundamental que existe una forma de vincular, y básicamente enciendes o apagas algo, ", Dijo Landes." Pero es obvio que este tipo de proteína receptora no solo está activa o desactivada. Hay múltiples interacciones conformacionales que mejoran o degradan la señalización ".
En un estudio anterior, el equipo analizó las conformaciones de un sistema más pequeño y simple pero relacionado, el dominio de unión agonista de tipo C-clamp de otro receptor, AMPA. AMPA media la transmisión rápida de señales en el sistema nervioso central. La técnica FRET de molécula única permitió a los investigadores obtener las primeras instantáneas de las diversas conformaciones de abrazadera de la proteína AMPA en reposo y también cuando se unen a un rango de moléculas objetivo midiendo la distancia entre dos etiquetas moleculares activadas por luz.
Esta vez, los investigadores intentaron comprender la apertura del canal en sí, cómo se mueven las proteínas que componen el canal del receptor NMDA para activar la puerta de iones. Al agregar etiquetas fluorescentes a lo largo del canal y muestrearlas a lo largo del tiempo, pudieron mapear el paisaje energético del segmento transmembrana de la proteína en su estado de reposo o bajo la influencia de ligandos que modulan la puerta entre abiertos, estados cerrados e intermedios. El estado estructural de cada canal influye directamente en las señales eléctricas que pueden pasar.
Descubrieron que el estado libre de agonistas (reposo) es estructuralmente rígido, lo que confirmó su enérgica resistencia a adoptar conformaciones que permitieran la apertura del canal. Los agonistas como el glutamato son las sustancias químicas objetivo que desencadenan el transporte de señales eléctricas a través del canal. Los investigadores confirmaron que en presencia del agonista primario, el canal NMDA era menos rígido y, por lo tanto, podía transitar más fácilmente entre las posibles conformaciones de canal abierto.
El trabajo también mostró cómo dos moduladores que se sabe interactúan con diferentes partes del receptor completo impactan la conformación y la rigidez del canal. Iones de zinc, a pesar de unirse a la porción extracelular del receptor lejos del canal, inducir un canal rígido con importantes barreras energéticas para la apertura, similar al estado de reposo del receptor. A diferencia de, Se descubrió que el "bloqueador de poros" dizocilpina mejora la energía de las transiciones entre múltiples conformaciones que no se relacionan con la apertura del canal.
Landes dijo que en lugar de capturar estados estáticos, como se suele hacer con los rayos X, "Estábamos analizando los cambios de distancia a lo largo del canal de forma dinámica. Es mucho más complicado". Eso les dio un conjunto de datos más parecido a una película que a una instantánea, ella dijo.
Dijo que el estudio requería nuevas técnicas para purificar y estabilizar las proteínas completas, que se extrajeron de las neuronas de los roedores. "Había tres piezas clave para este proyecto:manejar las proteínas completas, purificarlos y etiquetarlos a nivel de receptor único y realizar el análisis de datos para averiguar qué significa.
"Esa es realmente la base aquí, ", dijo." Ahora podemos hacer estas mediciones para sistemas mucho más complicados ".