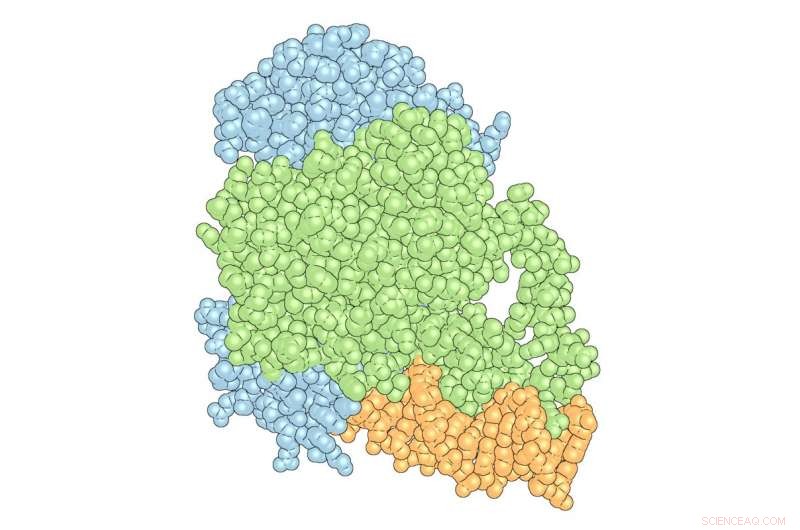
El 'complejo' de PPARγ (verde) y RXRα (azul) con ADN (naranja). Crédito:Instituto de Investigación Scripps
Con la creciente preocupación por los peligrosos efectos secundarios del fármaco antidiabético Avandia, una vez popular, investigadores del Instituto de Investigación Scripps (TSRI) en Júpiter, Florida, están trabajando para comprender cómo las moléculas pequeñas, como los de Avandia, puede tener efectos tan variados en todo el cuerpo. Los conocimientos podrían ayudar a los investigadores a diseñar nuevos medicamentos con mejor eficacia y menos efectos secundarios.
Douglas Kojetin, profesor asociado en TSRI, y su equipo publicó recientemente un estudio en Estructura , mostrando las formas en que Avandia interactúa y cambia la forma de una combinación de proteínas, receptores y ADN, llamados "complejos", que dan como resultado los efectos del fármaco. Además de ayudar a informar el diseño de futuros fármacos antidiabéticos, el estudio reveló que el ADN juega un papel activo en la determinación de la estructura del complejo, un hallazgo que tiene implicaciones para comprender cómo afecta al cuerpo cualquier fármaco de molécula pequeña.
Los investigadores del laboratorio de Kojetin se centran en los receptores nucleares:proteínas que pueden interactuar o "unirse" a ambos materiales genéticos, como el ADN y las moléculas pequeñas, así como unirse a otras proteínas llamadas proteínas correguladoras que impactan la expresión génica. Avandia, por ejemplo, se une a PPARγ, un receptor nuclear, que se une a secuencias de ADN importantes para regular el almacenamiento y el metabolismo de grasas. Pero PPARγ no funciona solo con Avandia. Un segundo receptor nuclear, RXRα, interactúa con PPARγ para formar un "heterodímero", un complejo formado por dos proteínas diferentes unidas entre sí que recluta una proteína co-reguladora llamada Coactivador-2 del Receptor de Esteroides (SRC-2) para influir en la actividad de muchos genes diferentes. A medida que cada pieza se une, el complejo cambia de forma, como pedazos de arcilla húmeda que se machacan para formar un cuenco.
El equipo se propuso comprender cómo las secciones específicas de ADN afectan la interacción entre el receptor nuclear y la proteína correguladora. Por ejemplo, ¿Este receptor nuclear interactuaría con la proteína correguladora de la misma manera si no estuviera unido al ADN?
Añadiendo una capa extra de complejidad, SRC-2 es una proteína intrínsecamente desordenada, una proteína "flácida" sin una estructura secundaria consistente que se mueve como un espagueti suelto. Esto significa que los métodos populares que los investigadores suelen utilizar para comprender la estructura de la proteína, como la cristalografía de rayos X, que requiere una muestra estable sin flop, no podría decirles mucho a los científicos sobre lo que está haciendo esta proteína.
El equipo de Kojetin utilizó una combinación de bioquímicos cuantitativos, métodos biofísicos y estructurales de solución para formar una comprensión detallada de estas interacciones moleculares. Cada técnica le dio a su equipo piezas de información que usaron para construir una imagen de cómo interactúan todas estas moléculas.
"Ninguna herramienta podría habernos dado la respuesta. En realidad, fue la combinación de todas estas herramientas lo que nos dio una imagen completa de lo que estaba sucediendo, "Dijo Kojetin.
Resultó que lo que estaba sucediendo era un mecanismo "termodinámico" por el cual la unión al ADN hacía que el heterodímero receptor cambiara su forma y estabilizara de manera importante sus regiones flexibles.
El equipo de Kojetin demostró que la interacción del ADN afectó la potencia de Avandia y su capacidad para reclutar la proteína correguladora. Los receptores por sí solos son como dos globos flotando aleatoriamente en el viento, explicó Kojetin. Cuando se unió al ADN, los receptores se estabilizan, como si los globos estuvieran atados juntos, facilitando que SRC-2 interactúe con él.
Si las proteínas se hubieran unido a otra porción de ADN, el complejo puede haber podido formar una forma diferente y ejercer una diferente, posiblemente incluso un efecto peligroso, o quizás ningún efecto en absoluto. Se exponen diferentes genes, o accesible, en diferentes tejidos corporales. Esto podría ayudar a explicar cómo las drogas pueden tener un efecto en un área determinada del cuerpo y un efecto diferente en otras áreas donde las secciones de ADN accesible son diferentes.
"El fármaco no controla la actividad en el cuerpo por sí mismo. Cuando el receptor se une a diferentes secuencias de ADN, la actividad de la droga podría cambiar ". Sabiendo esto, dijo Kojetin, "va a abrir muchas posibilidades".