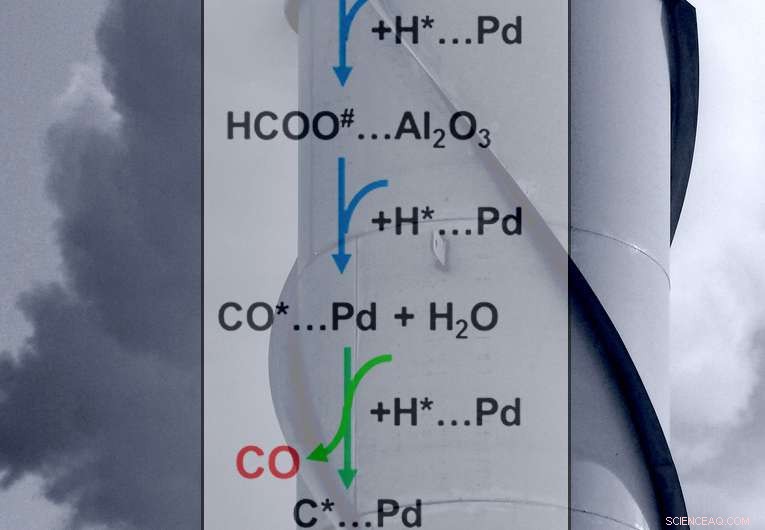
Las flechas verdes muestran el paso fundamental en el control de los productos finales de las reacciones:metano o monóxido de carbono. Crédito:Scott Butner
¿Y si pudiéramos convertir el dióxido de carbono, CO2, en un recurso valioso? El uso de CO2 como materia prima para crear combustibles u otros productos químicos ofrecería beneficios económicos y ambientales. El desafío es diseñar procesos efectivos que produzcan solo la sustancia química deseada:metano o monóxido de carbono. ¿Por qué? Los científicos no tenían una comprensión clara de los pasos fundamentales en el mecanismo de reacción. Científicos del Laboratorio Nacional del Noroeste del Pacífico, dirigido por el Dr. Janos Szanyi, determinó que el formato (HCOO-), un ion a menudo pasado por alto, fue un intermedio crítico en el proceso general de conversión de CO2. El equilibrio en las tasas de conversión de intermedios de formiato y monóxido de carbono determina qué productos químicos se producen.
"Este estudio nos brinda información crucial para utilizar una materia prima fácilmente disponible, CO2, y convertirlo en algo útil:un intermedio químico, monóxido de carbono, o un portador de energía, metano. Este intermedio se puede utilizar para la producción de hidrocarburos superiores, o combustibles, "dijo Szanyi.
Durante años, algunos consideraban que el formato no era más que un espectador, una molécula que no contribuyó a la reacción. Ahora, el equipo ha demostrado que el formato es realmente vital. Entendiendo los pasos, y el papel de los formates, permite a los científicos diseñar un catalizador selectivo que bombee los productos químicos deseados. Comprender los pasos de la reacción brinda a los científicos información crucial para controlar la reacción. Más lejos, el trabajo pone fin a una controversia de larga data sobre el papel de los formiatos en la superficie del catalizador.
En este estudio, un equipo del Laboratorio Nacional del Noroeste del Pacífico determinó los factores que controlan la selectividad de un catalizador para la hidrogenación de CO2 a monóxido de carbono o metano. Utilizaron una combinación novedosa de experimentos de transmisión operando FTIR y SSITKA (Espectroscopia infrarroja por transformada de Fourier / Análisis cinético transitorio isotópico en estado estacionario).
Determinaron el comportamiento de los intermedios clave (formiatos y monóxido de carbono) en la superficie del catalizador. Para la formación de monóxido de carbono, el paso que determina la tasa es la conversión, o reducción, de formiato adsorbido en la interfaz del catalizador de metal paladio y el soporte de óxido de aluminio. Para la formación de metano, el paso que determina la velocidad (vea las flechas verdes en la figura) es agregar hidrógeno al monóxido de carbono adsorbido. El equilibrio entre las tasas de reducción de formiato absorbido y la metanización de monóxido de carbono gobierna la selectividad del catalizador. Es decir, la selectividad gira en torno a la rapidez con que los intermedios en la superficie recogen hidrógeno, creando monóxido de carbono o metano.
Habiendo determinado los aspectos clave de la reacción, el equipo diseñó tres catalizadores con diferentes distribuciones de paladio. La cantidad de paladio en la superficie, ellos encontraron, es otro aspecto vital en la selección de los productos. El catalizador con la menor cantidad de paladio produjo tanto monóxido de carbono como metano, con mayor selectividad por el monóxido de carbono. A diferencia de, Se observó una selectividad superior al 80 por ciento hacia la formación de metano sobre el catalizador con la carga de metal más alta.
El equipo ahora está modificando el entorno alrededor del sitio activo del catalizador para ajustar su selectividad. Este trabajo tiene como objetivo reducir la cantidad de productos no deseados liberados. Además, el equipo está desarrollando métodos para preparar catalizadores de un solo átomo para aumentar la eficiencia de los metales preciosos involucrados.