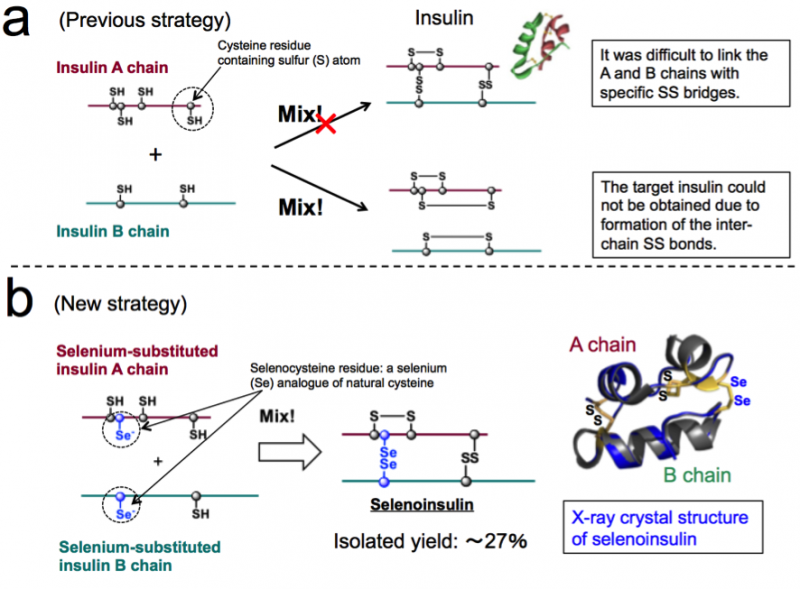
Figura 1. Síntesis química de insulina. (a) Estrategia previa basada en el acoplamiento entre las cadenas A y B de la insulina nativa. (b) Nueva estrategia que explota la naturaleza única de la selenocisteína y la estructura cristalina de rayos X de la selenoinsulina. (Estas cifras se citan del artículo original con modificaciones). Crédito:Universidad de Osaka
Un grupo de investigadores ha desarrollado selenoinsulina (Se-Ins) análogos sintéticos de insulina mediante la sustitución del disulfuro intercatenario de la insulina pancreática bovina (BPIns) por un puente de diselenida.
Este grupo demostró que los Se-Ins tenían una estructura y una bioactividad casi idénticas comparables a las de los BPins, y que tenía una mayor resistencia a la degradación de IDE. Esto es prometedor para la aplicación de Se-Ins a una preparación de insulina de larga duración en el tratamiento de la diabetes.
Después de circular en el torrente sanguíneo, La insulina es degradada por una enzima que degrada la insulina (IDE) en el riñón y se excreta en la orina. Este grupo pensó que la producción de insulina con alta resistencia a la degradación por IDE conduciría al desarrollo de un nuevo tipo de preparaciones de insulina de larga duración que podrían circular en el cuerpo durante mucho tiempo.
La insulina consta de dos cadenas polipeptídicas:la cadena A y la cadena B, conectado por un enlace disulfuro (enlace Se-Se), por lo que es difícil tomar insulina solo de estas cadenas debido a los enlaces Se-Se. Por lo tanto, este grupo pensó que si las cadenas A y B de la insulina contenían selenio (Se) en lugar de azufre (S), fueron usados, el enlace diselenide (enlace Se-Se) se formaría rápidamente y luego la reacción de ensamblaje en cadena podría llevarse a cabo de manera eficiente, ya que Se es más reactivo que S.
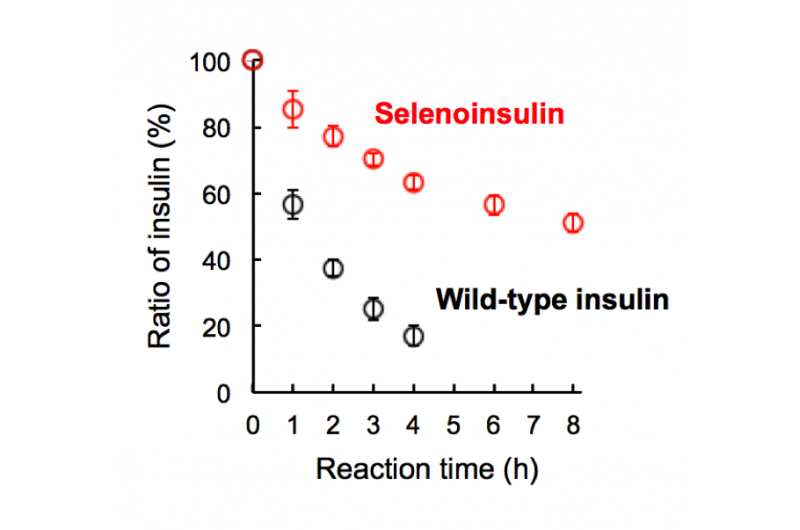
Figura 2. Degradación de selenoinsulina (rojo) e insulina de tipo salvaje (negro) por la enzima degradadora de insulina (IDE). (Esta cifra fue citada del artículo original con ligeras modificaciones). Crédito:Universidad de Osaka
Además, Los enlaces Se-Se son más estables que los enlaces S-S, por lo que este grupo anticipó que los enlaces Se-Se darían una robustez estructural adicional en el pliegue de la insulina, dando así como resultado una resistencia mejorada a la degradación de IDE debido a su estabilidad intrínseca. Basado en este concepto, este grupo logró la síntesis de cadenas A y B de insulina que contienen Se, así como la obtención de Se-Ins con un rendimiento de aislamiento de hasta un 27% mediante la reacción de cadenas peptídicas en condiciones óptimas.
Este grupo demostró que Se-Ins tenía una estructura casi idéntica a la de BPIns, sugiriendo que Se-Ins tiene una bioactividad comparable a la de BPIns. Los experimentos de degradación de BPIns y Se-Ins mediante el uso de IDE mostraron que la tasa de degradación de Se-Ins era mucho más lenta que la de BPIns. De esto, Se cree que Se-Ins tiene una naturaleza duradera y podría ser una nueva clase de análogos de insulina de acción prolongada para el tratamiento de la diabetes.
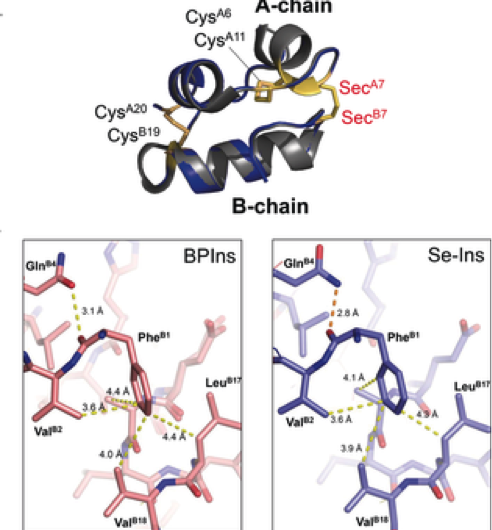
Figura 3. Preparación de selenoinsulina como análogo de insulina de larga duración. Crédito:Universidad de Osaka