Un modelo de una mini proteína diseñada computacionalmente de un estudio a gran escala del Instituto de Medicina para el Diseño de Proteínas de la Universidad de Washington. Crédito:Instituto de Medicina de UW para el Diseño de Proteínas
El escenario está listo para una nueva era de ingeniería molecular de proteínas basada en datos a medida que los avances en la tecnología de síntesis de ADN se fusionan con mejoras en el diseño computacional de nuevas proteínas.
De esta semana Ciencias informa la prueba a mayor escala de estabilidad de plegado para proteínas diseñadas computacionalmente, posible gracias a un nuevo enfoque de alto rendimiento.
Los científicos pertenecen al Instituto de Medicina de UW para el Diseño de Proteínas de la Universidad de Washington en Seattle y la Universidad de Toronto en Ontario.
El autor principal del artículo es Gabriel Rocklin, becario postdoctoral en bioquímica en la Facultad de Medicina de la Universidad de Washington. Los autores principales son Cheryl Arrowsmith, del Centro Oncológico Princess Margaret, el Consorcio de Genómica Estructural y el Departamento de Biofísica Médica de la Universidad de Toronto, y David Baker, Profesor de bioquímica de la Universidad de Washington e investigador del Instituto Médico Howard Hughes.
Las proteínas son caballos de batalla biológicos. Los investigadores quieren construir nuevas moléculas, no se encuentra naturalmente, que puede realizar tareas para prevenir o tratar enfermedades, en aplicaciones industriales, en la producción de energía, y en limpiezas ambientales.
"Sin embargo, Las proteínas diseñadas computacionalmente a menudo no logran formar las estructuras plegadas para las que fueron diseñadas cuando se prueban en el laboratorio. "Dijo Rocklin.
En el último estudio, los investigadores probaron más de 15, 000 mini-proteínas de nuevo diseño que no existen en la naturaleza para ver si forman estructuras plegadas. Incluso los principales estudios de diseño de proteínas en los últimos años han examinado generalmente solo de 50 a 100 diseños.
"Aprendimos mucho a esta nueva escala, pero el sabor nos ha dado un apetito aún mayor, ", dijo Rocklin." Estamos ansiosos por probar cientos de miles de diseños en los próximos años ".
Las pruebas más recientes llevaron al diseño de 2, 788 estructuras proteicas estables y podría tener muchas aplicaciones de bioingeniería y biología sintética. Su pequeño tamaño puede resultar ventajoso para el tratamiento de enfermedades cuando el fármaco necesita llegar al interior de una célula.
Las proteínas están formadas por cadenas de aminoácidos con secuencias específicas, y las secuencias de proteínas naturales están codificadas en el ADN celular. Estas cadenas se pliegan en conformaciones tridimensionales. La secuencia de aminoácidos en la guía de la cadena donde se doblará y retorcerá, y cómo las partes interactuarán para mantener unida la estructura.
Por décadas, Los investigadores han estudiado estas interacciones examinando las estructuras de las proteínas naturales. Sin embargo, Las estructuras proteicas naturales suelen ser grandes y complejas. con miles de interacciones que colectivamente mantienen la proteína en su forma plegada. Medir la contribución de cada interacción se vuelve muy difícil.
Los científicos abordaron este problema diseñando computacionalmente sus propios, proteínas mucho más simples. Estas proteínas más simples facilitaron el análisis de los diferentes tipos de interacciones que mantienen a todas las proteínas en sus estructuras plegadas.
"Todavía, Incluso las proteínas simples son tan complicadas que era importante estudiar miles de ellas para saber por qué se pliegan. ", Dijo Rocklin." Esto había sido imposible hasta hace poco, debido al costo del ADN. Cada proteína diseñada requiere su propio fragmento de ADN personalizado para que pueda fabricarse dentro de una célula. Esto ha limitado los estudios previos a probar solo decenas de diseños ".
Para codificar sus diseños de proteínas cortas en este proyecto, los investigadores utilizaron lo que se denomina tecnología de síntesis de bibliotecas de oligo de ADN. Fue desarrollado originalmente para otros protocolos de laboratorio, como el ensamblaje de genes grandes. Una de las empresas que proporcionó su ADN es CustomArray en Bothell, Wash. También utilizaron bibliotecas de ADN creadas por Agilent en Santa Clara, Calif., y Twist Bioscience en San Francisco.
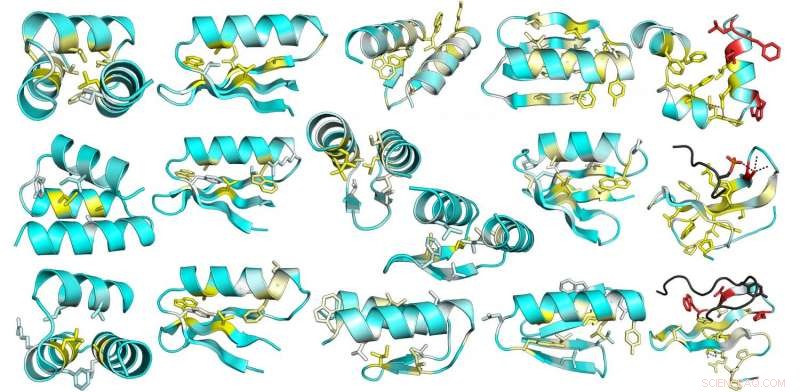
Esta imagen es de un análisis mutacional integral de estabilidad en proteínas naturales y diseñadas. El cambio promedio en la estabilidad debido a la mutación de cada posición en 13 proteínas diseñadas se representa en las estructuras del modelo de diseño. El amarillo indica posiciones donde las mutaciones son más desestabilizadoras; las posiciones donde hay poco efecto son azules Crédito:Instituto de Medicina de la Universidad de Washington para el Diseño de Proteínas
Repitiendo el ciclo de cálculo y pruebas experimentales en varias iteraciones, los investigadores aprendieron de sus fallas de diseño y mejoraron progresivamente su modelado. Su tasa de éxito de diseño aumentó del 6 por ciento al 47 por ciento. También produjeron proteínas estables en formas en las que fallaron todos sus primeros diseños.
Su gran conjunto de miniproteínas estables e inestables les permitió analizar cuantitativamente qué características de las proteínas se correlacionaban con el plegamiento. También compararon la estabilidad de sus proteínas diseñadas con proteínas de tamaño similar, proteínas de origen natural.
La proteína natural más estable que identificaron los investigadores fue una proteína muy estudiada de la bacteria Bacillus stearothermophilus. Este organismo disfruta de altas temperaturas, como los de las aguas termales y los respiraderos termales del océano. La mayoría de las proteínas pierden sus estructuras plegadas en condiciones de temperatura tan alta. Los organismos que prosperan allí han desarrollado proteínas altamente estables que permanecen plegadas incluso cuando están calientes.
"Un total de 774 proteínas diseñadas tenían puntuaciones de estabilidad más altas que esta proteína monomérica más resistente a las proteasas, "señalaron los investigadores. Las proteasas son enzimas que descomponen las proteínas, y fueron herramientas esenciales que los investigadores utilizaron para medir la estabilidad de sus miles de proteínas.
Los investigadores predicen que, a medida que la tecnología de síntesis de ADN continúa mejorando, El diseño de proteínas de alto rendimiento será posible para estructuras proteicas más complejas.
"Nos estamos alejando del antiguo estilo de diseño de proteínas, que era una mezcla de modelado por computadora, intuición humana, y pequeñas pruebas sobre lo que funcionó antes ", dijo Rocklin." Los diseñadores de proteínas eran como maestros artesanos que usaban su experiencia para esculpir a mano cada pieza en su taller. pero cuando fallaron, fue difícil decir por qué. Nuestro nuevo enfoque nos permite recopilar una enorme cantidad de datos sobre lo que hace que las proteínas sean estables. Estos datos ahora pueden impulsar el proceso de diseño ".