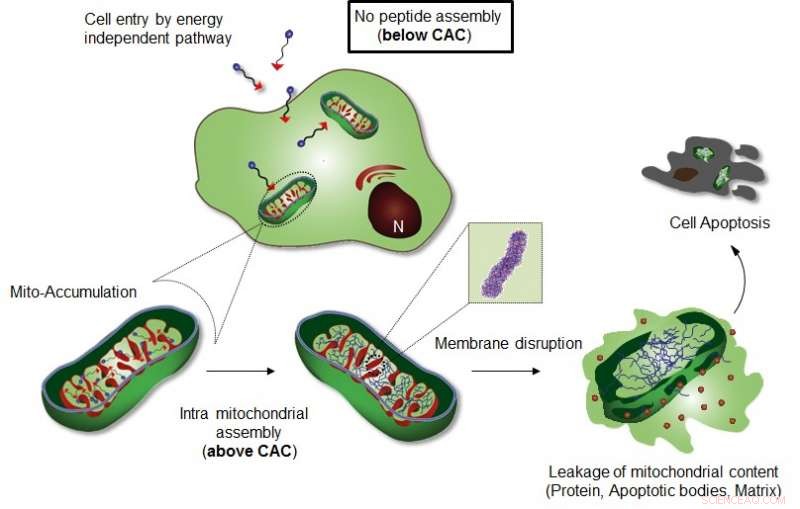
La figura muestra el ensamblaje intra-mitocondrial de Mito-FF. Crédito:UNIST
Ensamblaje in situ de péptidos anfifílicos con funciones celulares acompañantes dentro de una célula viva (es decir, ensamblaje intracelular) y su interacción con los componentes celulares han surgido como una estrategia versátil para controlar el destino celular. Sin embargo, lograr el control espacio-temporal (es decir, dentro de orgánulos celulares u otros subcompartimentos) sobre el autoensamblaje de moléculas sintéticas dentro de la célula es un desafío debido a la dificultad de estudiar sus comportamientos en el complejo entorno intracelular.
Un estudio reciente, afiliado a UNIST ha desarrollado un nuevo método para atacar las mitocondrias de una célula cancerosa. El equipo de investigación espera que su estudio pueda allanar el camino para una nueva generación de medicamentos contra el cáncer.
Esta investigación ha sido dirigida por el profesor Ja-Hyoung Ryu de Química en UNIST en colaboración con Sang Kyu Kwak de Energía e Ingeniería Química en UNIST y el Profesor Eunji Lee de la Escuela de Graduados en Ciencia y Tecnología Analítica de la Universidad Nacional de Chungam. Los resultados del estudio han aparecido en la edición del 21 de abril de Comunicaciones de la naturaleza.
En el estudio, el equipo de investigación conjunto ha presentado, por primera vez, el autoensamblaje localizado en orgánulos de un péptido anfífilo como una poderosa estrategia para controlar el destino celular.
El autoensamblaje es un proceso de equilibrio entre las unidades de construcción individuales y su estado agregado, y la concentración de las moléculas debe estar por encima del valor crítico para inducir el ensamblaje (es decir, la concentración crítica de agregación (CAC). En células vivas, También se requiere lograr el CAC para formar conjuntos de moléculas individuales, pero tiene una limitación porque la complejidad química de los entornos celulares interrumpe las interacciones entre las unidades de construcción sintéticas.
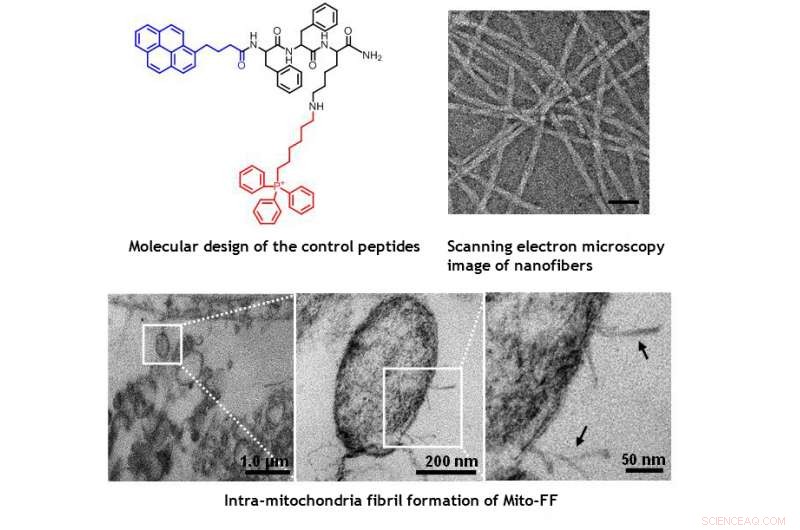
Imágenes TEM de mitocondrias dentro de la célula HeLa que muestran el daño morfológico inducido por Mito-FF. Crédito:UNIST
Autoensamblaje intracelular, por lo tanto, requiere una mayor concentración de moléculas que el CAC, lo que puede limitar las implementaciones prácticas de moléculas autoensambladas. Transformación de la estructura molecular de unidades hidrófilas a hidrófobas dentro de la célula (o espacio pericelular) a través de estímulos externos (químicos, o físico) es una estrategia poderosa para reducir el CAC al aumentar la propensión al autoensamblaje. Sin embargo, estímulos químicos y físicos (por ejemplo, luz, temperatura, pH y redox) no son relevantes para el ensamblaje intracelular porque inducen un daño severo a la célula.
El equipo de investigación del profesor Ryu introdujo un sistema de autoensamblaje supramolecular inducido por localización de orgánulos celulares (OLISA) que podría ser una estrategia general para inducir el autoensamblaje al aumentar las concentraciones locales de las moléculas de autoensamblaje sin tratamiento adicional. Las pequeñas moléculas se difunden fácilmente a través de la membrana celular, llegar al sitio de destino (orgánulo o compartimento subcelular dependiendo de la fracción de destino), y luego se autoensamblan dentro del orgánulo objetivo como resultado de una mayor concentración local. La acumulación de moléculas dentro de un orgánulo como las mitocondrias es ~ 500-1, 000 veces mayor que la del espacio extracelular.
"OLISA es una estrategia más general y directa para lograr el ensamblaje intracelular y es completamente nueva, es un enfoque prometedor para controlar el destino celular como la apoptosis, proliferación celular, etc. y es una estrategia útil para sus investigaciones en profundidad ", dice el profesor Ryu.
El diseño consiste en péptido anfifílico acumulador de mitocondrias (Mito-FF), que consiste en difenilalanina como un bloque de construcción formador de láminas β, TPP como resto de direccionamiento mitocondrial, y pireno como sonda fluorescente. Mito-FF se acumuló favorablemente en las mitocondrias de las células cancerosas debido al alto potencial de membrana negativo y el aumento de concentración hizo que Mito-FF se autoensamblara en una estructura fibrosa. mientras que se observó falta de formación de fibrillas en células normales. Las fibrillas rígidas de Mito-FF destruyeron la membrana mitocondrial y activaron la vía apoptótica intrínseca contra las células cancerosas. Este sistema OLISA ofrece un nuevo enfoque para la quimioterapia dirigida contra el cáncer.
MONTE. Jeena de Química en UNIST, el autor principal del estudio espera que el nuevo método establezca las bases para una nueva serie de tratamientos que podrían maximizar el proceso de curación y minimizar los efectos secundarios.