
Por primera vez, los científicos han captado la maquinaria celular que produce una molécula vital en el proceso de evolución. Una enzima clave que utilizan las plantas para producir tirosina, un aminoácido necesario para la vida, Se pensaba que se conservaba en todo el reino vegetal, pero los científicos descubrieron que había mutado a otra forma en las leguminosas. En los tomates cherry domina la forma canónica de la enzima, los cacahuetes pueden cambiar de golpe y algunas cepas de soja (frijoles grumosos a la derecha) han perdido la forma canónica. Crédito:Jez Lab
Porque las plantas no pueden levantarse y huir, en su lugar, han tenido que ser inteligentes. Son los químicos del mundo viviente, produciendo cientos de miles de pequeñas moléculas que utilizan como protectores solares, para envenenar a los herbívoros, para oler el aire, colorear flores, y para muchos otros asuntos vegetativos secretos.
Históricamente, estos productos químicos, llamados "metabolitos secundarios, "se han distinguido de" metabolitos primarios, "que son los componentes básicos de las proteínas, grasas azúcares y ADN. Los metabolitos secundarios suavizan el camino en la vida, pero los metabolitos primarios son esenciales, y el no hacerlos correcta y eficientemente es fatal.
Se cree que el metabolismo secundario ha evolucionado para ayudar a los antepasados de las plantas a lidiar con la vida en tierra firme en lugar de los océanos más hospitalarios. La idea es que se duplicaron los genes de las enzimas en las líneas de ensamblaje molecular del metabolismo primario. Los duplicados eran más tolerantes con las mutaciones que podrían haber desestabilizado las vías primarias porque los originales todavía estaban trabajando. Con las limitaciones evolutivas así relajadas, La maquinaria sintética fue capaz de acumular suficientes mutaciones para hacer nueva química.
Metabolismo primario, sin embargo, está ampliamente conservado, lo que significa que permanece sin cambios en muchos grupos diferentes de organismos porque se ha ajustado para funcionar de manera correcta y eficiente y porque sus productos son necesarios para la vida. O eso dicen los libros de texto.
Pero ahora un equipo colaborativo de científicos ha captado el metabolismo primario en el acto de evolucionar. En un estudio exhaustivo de una línea de ensamblaje de metabolismo primario en plantas, descubrieron una enzima clave que evoluciona a partir de una forma canónica que poseen la mayoría de las plantas, a través de formas no canónicas en tomates, a una forma de cambio que se encuentra en los cacahuetes, y finalmente comprometerse con la forma novedosa en algunas cepas de soja.
Esta hazaña comparable a sacar el mantel de debajo de los platos sin romper ninguno de ellos, se describe en la edición del 26 de junio de Biología química de la naturaleza . Es el trabajo de una colaboración entre el laboratorio Maeda de la Universidad de Wisconsin, que tiene un interés de larga data en esta vía bioquímica, y el laboratorio Jez de la Universidad de Washington en St. Louis, que cristalizó la enzima de la soja para revelar cómo la naturaleza cambió el funcionamiento de la proteína.
"El trabajo captura plantas en el proceso de construir una vía que vincula el metabolismo primario con el secundario, "dijo Joseph Jez, el Profesor del Instituto Médico Howard Hughes en el Departamento de Biología en Artes y Ciencias. "Finalmente estamos viendo cómo la evolución crea la maquinaria para producir nuevas moléculas".
También puede tener importancia práctica porque las vías antiguas y nuevas producen el aminoácido tirosina, que es un precursor de muchos metabolitos secundarios con actividad biológica y farmacéutica, desde la vitamina E hasta los opioides. Pero la vieja vía produce solo pequeñas cantidades de estos compuestos, en parte porque deben competir por los átomos de carbono con el codicioso proceso de producción de lignina, los polímeros resistentes que permiten que las plantas se mantengan erguidas.
El descubrimiento de la nueva vía para producir tirosina es mucho menos limitado que el anterior. Esto plantea la posibilidad de que el flujo de carbono se desvíe de la lignina, aumentar los rendimientos de medicamentos o nutrientes a niveles que permitan producirlos en cantidades comerciales.
Una historia de dos enzimas
La tirosina se fabrica en una línea de ensamblaje llamada vía shikimate, una vía metabólica de siete pasos que utilizan las plantas para producir los tres aminoácidos que tienen anillos aromáticos. Los animales (incluidas las personas) perdieron la capacidad de erigir esta línea de montaje en lo profundo del pasado evolutivo. Debido a que no podemos producir estos aminoácidos por nuestra cuenta y son esenciales para la vida, en cambio, debemos obtenerlos comiendo plantas u hongos.
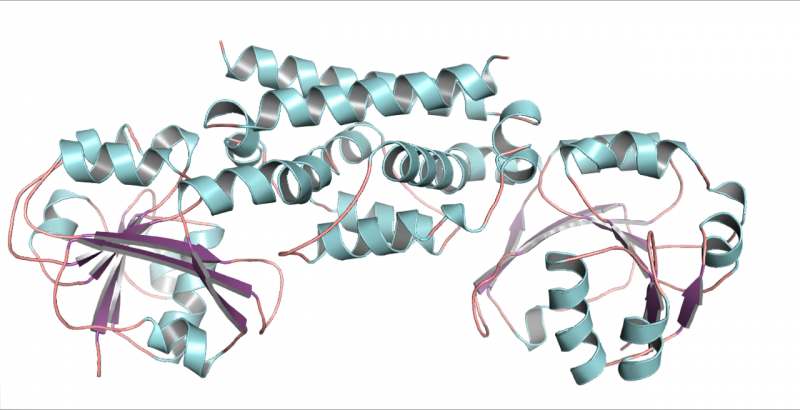
Una estructura tridimensional de la enzima PDH de la soja, una legumbre. Esta estructura ayudó a demostrar que solo una mutación permitió a las leguminosas desarrollar una nueva forma de producir el aminoácido tirosina. Crédito:Craig Schenck
Ese anillo aromático es importante, dijo Jez, porque es una estructura distintiva que puede absorber luz o energía. Entonces, los aminoácidos aromáticos también son los precursores de muchos metabolitos secundarios que capturan la luz, transferir electrones, o flores de colores. Es más, los aminoácidos aromáticos también son precursores de sustancias químicas que envenenan a otras plantas o depredadores de plantas y atraen a los polinizadores. Muchas drogas medicinales incluyen un anillo aromático, Comentó Jez.
En la mayoría de las plantas, la vía del shikimato está en el cloroplasto, el orgánulo que hace el trabajo de convertir la energía de la luz solar en energía almacenada en enlaces de carbono. Una vez hecho, sin embargo, la tirosina se puede exportar fuera del citosol para su incorporación o conversión en otros compuestos.
En el último paso de una rama de la vía, una enzima llamada arogenación deshidrogenasa (ADH), cataliza una reacción que hace que el compuesto se oxigene en tirosina. La enzima ADH se considera "reguladora" porque es un cuello de botella en la producción de tirosina. Debe competir por el sustrato arogenado con la rama de la vía del shikimato que produce un aminoácido aromático diferente y es fuertemente inhibido por la acumulación de tirosina.
La actividad de ADH es común en plantas, pero en el curso del estudio de la vía del shikimato, el laboratorio de Maeda descubrió que las secuencias de ADN que codifican la ADH en algunas plantas con flores eran significativamente diferentes de las de la mayoría de las plantas. Llamaron a las enzimas producidas por estas secuencias ADH no canónicas. Luego, en 2014, informaron que algunas legumbres también producen tirosina con una enzima diferente, llamada prefenato deshidrogenasa (PDH).
La PDH se diferencia de la ADH en muchos aspectos. Es activo fuera del cloroplasto, actúa sobre el sustrato prefenato en lugar de arogenado, debido a que está fuera del cloroplasto, no tiene que competir por su sustrato con otras ramas de la vía del shikimato, y no se inhibe por el aumento de los niveles de tirosina.
¿Por qué hay dos líneas de montaje diferentes para la tirosina? Los científicos creen que la enzima PDH evolucionó a través de dos eventos de duplicación de genes y la acumulación de mutaciones en las copias "extra" del gen. El primer evento dio lugar a ADH no estándar en algunas plantas con flores y el segundo a PDH en un subconjunto de leguminosas. Pero, ¿por qué sucedió esto?
Esa no es una pregunta que los científicos puedan responder todavía, excepto en términos generales, Dijo Jez. Lo que sobresale sin embargo, es que la vía metabólica de evolución más reciente no está estrictamente regulada y podría producir un producto a un ritmo vertiginoso. Quizás las legumbres necesitaban urgentemente metabolitos secundarios por alguna razón. Ciertamente es sospechoso que las leguminosas tengan una ecología bastante diferente a la de otras plantas, ya que viven simbióticamente con bacterias fijadoras de nitrógeno.
Jugando los bits
En este punto, los científicos sabían que la nueva enzima, PDH, unió un sustrato diferente al de la enzima original, ADH. También sabían que PDH, a diferencia de ADH, no se unió a la tirosina en sí. Pero, ¿qué cambios en la estructura llevaron a estas diferencias en la actividad química?
Descubrir, Craig Schenck, un estudiante de posgrado en el laboratorio de Maeda, comparó las secuencias de genes para la enzima ADH o PDH en muchas plantas diferentes, elegido cuidadosamente para estar en los límites del cambio de una enzima a la otra. Pero encontraron un problema. Había suficientes diferencias en el ADN que era difícil ver qué era relevante, Dijo Jez.
Encontrando a Maeda en una conferencia, Jez se ofreció a intentar cristalizar las nuevas enzimas para que su estructura pudiera reconstruirse a partir de imágenes de rayos X. Su estudiante de posgrado Cynthia Holland pudo cristalizar la PDH de la soja y producir imágenes detalladas de su forma tridimensional.
"Una vez que miró la estructura, pudo ver que solo había dos diferencias con respecto al ADH típico que se encuentra en la mayoría de las plantas y solo una de las diferencias realmente cambió las cosas, "Dijo Jez. Sorprendentemente, esa diferencia fue un solo aminoácido en el sitio activo de la enzima. En ese punto, la asparagina había reemplazado al ácido aspártico.
Schenck verificó dos veces esta información estructural cambiando ese aminoácido en formas mutantes de la enzima. El mutante ADH resultó tener actividad PDH, y el mutante PDH tenía actividad ADH, tal como había sospechado el equipo.
"Esa única diferencia cambia el sustrato preferido de la enzima y su capacidad para ser inhibida por la retroalimentación de tirosina, "Jez dijo." Y si lo miras, es literalmente la diferencia entre un átomo de nitrógeno o un átomo de oxígeno. En estas proteínas, que se componen de casi trescientos aminoácidos o cuarenta y doscientos átomos, un átomo marca la diferencia. Eso es algo genial ".
El trabajo es importante porque demuestra que el metabolismo primario evoluciona. Y porque muestra cómo la naturaleza roba maquinaria del metabolismo primario y la improvisa para producir nuevos metabolitos secundarios. Lo hacen con mucha más delicadeza de la que los ingenieros genéticos pueden manejar.
"Cuando queremos que una planta produzca una nueva molécula, "Jez dijo, "Dejamos caer un gen y esperamos que se integre con las vías existentes. Todavía no sabemos cómo conectar fácilmente el cableado entre lo que dejamos caer y lo que ya está allí. Así que es interesante ver cómo la naturaleza se las ingenió para conectar el cableado y cambiar las cosas sin romperlas ".