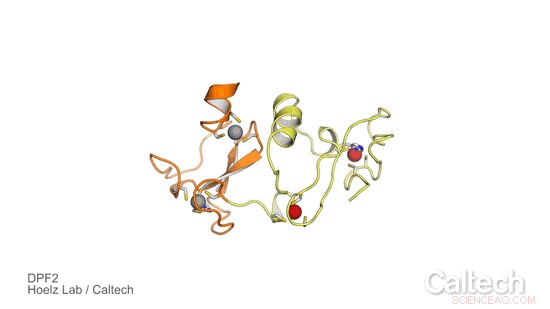
Una estructura cristalina de una porción de DPF2 humano, una proteína que controla un interruptor genético que le dice a las células madre sanguíneas cuándo convertirse en glóbulos rojos y blancos. Las regiones naranja y amarilla ilustran el dominio de 'lector' de DPF2, que está estabilizado por iones de zinc, representado como esferas rojas y grises. Crédito:Laboratorio Hoelz / Caltech
Muchas cosas van mal en las células durante el desarrollo del cáncer. En el corazón del caos a menudo hay interruptores genéticos que controlan la producción de nuevas células. En una forma particularmente agresiva de leucemia, llamada leucemia mieloide aguda, falla un interruptor genético que regula la maduración de las células madre sanguíneas en glóbulos rojos y blancos. Normalmente, este cambio conduce a un número apropiado de glóbulos blancos y rojos. Pero los pacientes con leucemia mieloide aguda terminan con una acumulación peligrosa de células madre sanguíneas y una falta de glóbulos rojos y blancos, células necesarias para suministrar oxígeno al cuerpo y combatir las infecciones.
Ahora, Los investigadores de Caltech y el Sylvester Comprehensive Cancer Center de la Universidad de Miami se están centrando en una proteína que ayuda a controlar este cambio genético. En individuos sanos, la proteína, llamado DPF2, detiene la producción de glóbulos rojos y blancos cuando no es necesario reemplazarlos. Es decir, apaga el interruptor. Pero la proteína puede producirse en exceso en pacientes con leucemia mieloide aguda. La proteína básicamente se encuentra en el interruptor, evitando que se vuelva a encender para producir las células sanguíneas según sea necesario. Los pacientes que sobreproducen DPF2 tienen un pronóstico particularmente desfavorable.
En un nuevo estudio, que se publicará la semana del 22 de mayo, 2017, en el diario procedimientos de la Academia Nacional de Ciencias , los investigadores demuestran nuevas formas de impedir el DPF2, potencialmente haciendo que la leucemia mieloide aguda sea más tratable. Informan nuevos detalles estructurales y funcionales sobre un fragmento de DPF2. Esta nueva información revela objetivos para el desarrollo de fármacos que bloquearían la función de la proteína.
"Muchas enfermedades humanas, incluidos los cánceres, surgen debido a un mal funcionamiento de los interruptores genéticos, "dice André Hoelz, el autor correspondiente del estudio. Hoelz es profesor de química en Caltech, un investigador del Heritage Medical Research Institute (HMRI), y un académico académico del Instituto Médico Howard Hughes (HHMI). "Aclarar cómo funcionan en detalle atómico nos permite comenzar el proceso de adaptación de medicamentos personalizados para inactivarlos y, en muchos casos, es un paso significativo hacia una cura".
Los glóbulos rojos y blancos se regeneran constantemente a partir de células madre sanguíneas, que residen en nuestra médula ósea. Como otras células madre, las células madre sanguíneas pueden vivir para siempre. Es solo cuando se diferencian en tipos de células específicos, como glóbulos rojos y blancos, que luego se vuelven mortales, o adquirir la capacidad de morir después de un cierto período de tiempo.
"Nuestros cuerpos utilizan una serie compleja de interruptores genéticos para diferenciar una célula madre sanguínea en muchos tipos de células diferentes. Estas células diferenciadas luego circulan en la sangre y cumplen una variedad de funciones diferentes. Cuando estas células alcanzan el final de su vida útil, necesitan ser reemplazado, ", dice Hoelz." Esto es algo así como reemplazar neumáticos usados en un automóvil ".
Para investigar el papel del DPF2 y aprender más sobre cómo controla el interruptor genético para producir células sanguíneas, el grupo Hoelz se asoció con Stephen D. Nimer, coautor correspondiente del artículo y director del Sylvester Comprehensive Cancer Center, y su equipo. Primero, Ferdinand Huber y Andrew Davenport, ambos estudiantes graduados de Caltech en el grupo Hoelz y coautores primeros del nuevo estudio, obtuvieron cristales de una porción de la proteína DPF2 que contiene un dominio conocido como dedo PHD, que significa homeodominio planetario. Luego utilizaron cristalografía de rayos X, un proceso que implica exponer cristales de proteínas a rayos X de alta energía, para resolver la estructura del dominio de dedos PHD. La técnica se realizó en el Stanford Synchrotron Radiation Lightsource, utilizando una línea de luz dedicada del Observatorio Molecular de Caltech.
Los resultados revelaron cómo DPF2 se une a un complejo ADN-proteína, llamado nucleosoma, para bloquear la producción de glóbulos rojos y blancos. La proteína "lee" varias señales mostradas en la superficie del nucleosoma adoptando una forma que se ajusta a varias modificaciones en el complejo del nucleosoma, como las piezas de diferentes formas de un rompecabezas. Una vez que la proteína se une a este locus de ADN, DPF2 apaga el interruptor que regula la diferenciación de células sanguíneas.
El siguiente paso fue ver si el DPF2 podía bloquearse en las células madre de la sangre humana en el laboratorio. Sarah Greenblatt, un asociado postdoctoral en el grupo de Nimer y co-primer autor del estudio, utilizó la información estructural del grupo de Hoelz para crear una versión mutada de la proteína. Luego, el grupo Nimer introdujo la proteína mutada en las células madre sanguíneas, y encontró que el DPF2 mutado ya no podía unirse al nucleosoma. En otras palabras, DPF2 ya no pudo desactivar el interruptor para producir glóbulos.
"El DPF2 mutado no pudo unirse a regiones específicas del genoma y no pudo detener la diferenciación de las células madre sanguíneas, ", dice Huber." Queda por ver si el DPF2 también se puede bloquear en los propios pacientes con cáncer ". Los investigadores dicen que un encaje estructural en el DPF2, una de las regiones similares a piezas de rompecabezas identificadas en el nuevo estudio, es un buen objetivo para los fármacos candidatos.