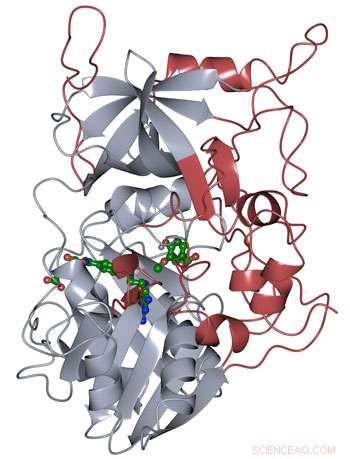
La estructura de la proteína de LigM se determinó mediante cristalografía de rayos X, revelando elementos estructurales novedosos que son exclusivos de LigM (rojo) además de un dominio de unión de tetrahidrofolato conservado (gris) que se encuentra a lo largo de la vida. LigM se une a sus sustratos (verde) mediante cavidades internas de unión. Crédito:Amanda Kohler / JBEI
Una proteína utilizada por las bacterias comunes del suelo está proporcionando nuevas pistas en el esfuerzo por convertir los compuestos de arilo, un producto de desecho común de prácticas industriales y agrícolas, en algo de valor.
Investigadores del Laboratorio Nacional Lawrence Berkeley del Departamento de Energía (Berkeley Lab) y los Laboratorios Nacionales Sandia que trabajan en el Instituto Conjunto de BioEnergía (JBEI) han resuelto la estructura proteica de la enzima LigM, que es utilizado por la bacteria del suelo Sphingomonas para metabolizar compuestos arílicos derivados de la lignina, el rígido material orgánico que le da a las plantas su estructura.
Su trabajo se informa hoy en el procedimientos de la Academia Nacional de Ciencias .
En la producción de biocombustibles, Los compuestos de arilo son un subproducto de la descomposición de la lignina. Muchas de las vías que conducen a la degradación de la lignina implican la desmetilación, que a menudo es un precursor crítico de cualquier paso adicional en la modificación de compuestos de arilo derivados de la lignina.
La autora principal del estudio, Amanda Kohler, Investigador postdoctoral del JBEI en Sandia, señaló que LigM es una desmetilasa atractiva para su uso en conversión aromática porque es una simple, sistema de una sola enzima. LigM también puede mantener su funcionalidad en un amplio rango de temperatura.
"Cuando intentamos construir nuevas vías en biología sintética, cuanto más simple sea el sistema, mejor, "dijo Kohler.

La investigadora postdoctoral Amanda Kohler establece las reacciones enzimáticas como parte del Grupo de Optimización de Enzimas de JBEI. Crédito:Marilyn Chung / Berkeley Lab
Los investigadores encontraron que la mitad de la enzima LigM era homóloga a estructuras conocidas con un dominio de unión al tetrahidrofolato que se encuentra en organismos simples y complejos por igual. La otra mitad de la estructura de LigM es completamente única, proporcionando un punto de partida para determinar dónde se encuentra su sitio de unión al sustrato de arilo. También descubrieron que LigM es una desmetilasa dependiente de tirosina.
"Es el primero de su tipo en ser identificado, ", dijo Kohler." Esta investigación proporciona el trabajo preliminar muy necesario para ayudar en el desarrollo de un sistema basado en enzimas para convertir los productos de desecho aromáticos en algo útil ".
Kohler dijo que ahora están trabajando en la ingeniería de LigM para que pueda actuar en una gama más amplia de sustratos de arilo, además de dirigirse a productos de desecho de arilo específicos.