Las proteínas antiguas pueden ofrecer pistas sobre la ingeniería de proteínas para resistir las altas temperaturas requeridas en aplicaciones industriales. Crédito:Instituto Politécnico Rensselaer
Las proteínas antiguas pueden ofrecer pistas sobre cómo diseñar proteínas que puedan soportar las altas temperaturas requeridas en aplicaciones industriales. según una nueva investigación publicada en el procedimientos de la Academia Nacional de Ciencias . Los investigadores utilizaron experimentos para examinar diferencias críticas entre 15 proteínas de la familia de las tiorredoxinas, incluyendo siete secuencias de proteínas extintas que datan de hace más de 4 mil millones de años y fueron resucitadas usando reconstrucciones de secuencias ancestrales.
"En aplicaciones industriales, las proteínas podrían hacer parte del trabajo de los productos químicos con menos energía y menos toxicidad, pero tienen que poder soportar las temperaturas más altas de los procesos industriales, "dijo George Makhatadze, Profesor Constelación de Biocomputación y Bioinformática y miembro del Centro de Biotecnología y Estudios Interdisciplinarios del Instituto Politécnico Rensselaer. "Esta investigación sugiere que los métodos de reconstrucción ancestral se pueden utilizar para diseñar proteínas que se despliegan más lentamente, ofreciendo mayor utilidad, a temperaturas más altas ".
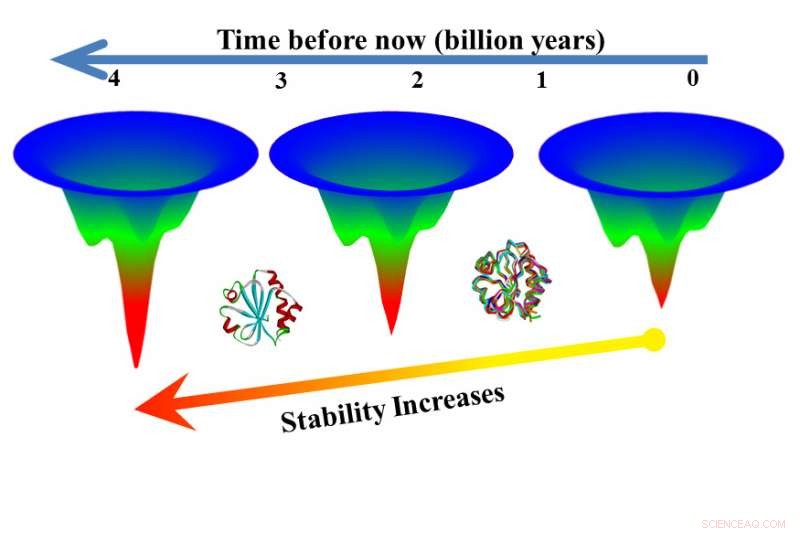
Los experimentos demostraron que la diferencia de estabilidad entre proteínas de la misma familia se debe principalmente a diferencias en la energía necesaria para desplegar las proteínas. un hallazgo que sostiene una teoría de larga data conocida como el "principio de frustración mínima, propuesto por los físicos hace unos 30 años.
Las proteínas son cadenas moleculares en las que cada enlace es uno de los 20 aminoácidos. Una vez ensamblada la cadena, varias fuerzas a lo largo de su longitud interactúan, haciendo que la cuerda se retuerza y gire, y finalmente se pliega en una forma tridimensional. La proteína solo puede realizar su función cuando se pliega correctamente. La mayoría de las proteínas permanecen plegadas dentro de un rango de temperatura establecido, pH o condiciones de presión, romperse cuando se somete a condiciones fuera de estas tolerancias.
No se conocen todas las reglas que gobiernan el plegamiento de proteínas, y Makhatadze quería entender cómo las proteínas dentro de la misma familia, con estructura similar, son capaces de realizar la misma función de soporte vital en entornos térmicos muy diferentes. Tiorredoxinas, por ejemplo, están presentes en todos los organismos, desde los que viven cerca de los respiraderos hidrotermales hirviendo hasta las gélidas aguas árticas.
Una regla conocida ayuda a explicar por qué hay un número astronómico de secuencias posibles para proteínas con cientos e incluso miles de enlaces. pero solo un pequeño subconjunto de esas posibles secuencias se encuentra en la naturaleza. Esta regla, el principio de frustración mínima, postula que la naturaleza elige solo aquellas secuencias que se pliegan de manera más eficiente, reduciendo las interacciones no deseadas entre los aminoácidos y produciendo más rápido, menos frustrado, patrones de plegado.
Para ser coherente con el principio de frustración mínima, Makhatadze dijo:Las proteínas con estructura similar pero diferente estabilidad termodinámica deben plegarse siguiendo el mismo patrón eficiente, pero aquellos con mayor capacidad para tolerar el calor deberían tardar más en desplegarse. Experimentos realizado primero con ocho tiorredoxinas modernas, demostró que la hipótesis era correcta.
"Probamos las tasas de plegamiento entre las tiorredoxinas, una familia de proteínas que realizan la misma función pero, debido a que funcionan en diferentes condiciones térmicas, deben ser diferentes en términos de termodinámica, ", dijo Makhatadze." Y lo que observamos es que para estas proteínas, de hecho, se pliegan con la misma tasa, pero se desarrollan a un ritmo diferente, que es lo que predijimos ".
En el siguiente paso, Los investigadores probaron versiones extintas de tiorredoxinas que se habían obtenido mediante una técnica llamada reconstrucción de secuencias ancestrales. Las versiones extintas se desarrollaron más lentamente que las versiones modernas, en algún caso plegable 3, 000 veces más lento que una contraparte moderna.
"Aquí tenemos dos versiones de una proteína de la misma familia y una desarrollada en siete segundos, el otro en seis horas, "Dijo Makhatadze." Eso significa que puede obtener una función útil de la proteína durante seis horas frente a siete segundos. Esto muestra que la reconstrucción de la secuencia ancestral puede ser una ruta hacia proteínas que son más estables a altas temperaturas ".
El hallazgo está respaldado por investigaciones y datos geoquímicos publicados anteriormente que indican que la Tierra y sus océanos estaban más calientes en el pasado antiguo.
"Investigaciones anteriores respaldan el hallazgo de que las proteínas más antiguas son más estables, pero esta nueva investigación muestra que estas proteínas antiguas son más estables porque se despliegan más lentamente, "Dijo Makhatadze.
"La evidencia del principio de frustración mínima en la evolución de los paisajes de plegamiento de proteínas" se puede encontrar utilizando el identificador de objeto digital DOI:10.1073 / pnas.1613892114. La investigación fue apoyada por la National Science Foundation. Makhatadze se unió a la investigación por Fanco Tzul, un investigador asociado postdoctoral, y el estudiante de posgrado Daniel Vasilchuk.
La investigación de Makhatadze está habilitada por la visión de The New Polytechnic, un paradigma emergente para la educación superior que reconoce que los desafíos y oportunidades globales son tan grandes que no pueden ser abordados adecuadamente ni siquiera por la persona más talentosa que trabaja sola. Rensselaer sirve como una encrucijada para la colaboración:trabajar con socios en todas las disciplinas, sectores, y regiones geográficas:para abordar desafíos globales complejos, utilizando las herramientas y tecnologías más avanzadas, muchos de los cuales se desarrollan en Rensselaer. La investigación en Rensselaer aborda algunos de los desafíos tecnológicos más urgentes del mundo, desde la seguridad energética y el desarrollo sostenible hasta la biotecnología y la salud humana. La Nueva Politécnica es transformadora en el impacto global de la investigación, en su pedagogía innovadora, y en la vida de los estudiantes de Rensselaer.