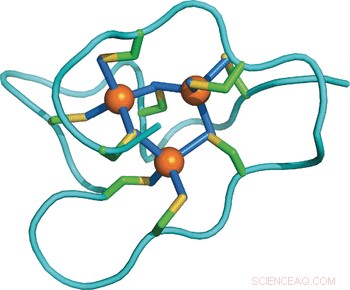
Adaptación estructural de una proteína a un mayor estrés por metales:estructura de RMN de una metalotioneína de caracol marino con un dominio adicional. Crédito:Wiley
Un tipo especial de proteína pequeña rica en azufre, metalotioneínas, tienen una capacidad extraordinaria para unir metales pesados. Un equipo internacional de científicos ha descubierto ahora que el bígaro común marino, que se considera un manjar, contiene la versión más grande de la proteína encontrada hasta ahora, con un dominio adicional de unión a cadmio y una capacidad de desintoxicación un tercio más alta. Como informan en la revista Angewandte Chemie , esta característica puede ayudar al caracol a sobrevivir en ambientes contaminados por metales pesados.
Los caracoles y las babosas son conocidos por su intrigante habilidad para acumular y desintoxicar metales pesados. Incluso son capaces de discriminar entre cadmio y cobre, como este último elemento es un elemento indispensable en su metabolismo, mientras que el cadmio es tóxico. Desintoxican el cadmio uniéndolo a las metalotioneínas, una clase de pequeñas proteínas ricas en el aminoácido cisteína que contiene azufre. Oliver Zerbe en la Universidad de Zurich, Suiza, y Reinhard Dallinger en la Universidad de Innsbruck, Austria, y sus compañeros de Barcelona, España, investigar la evolución de estas proteínas como una estrategia para adaptar los gasterópodos a sus nuevos hábitats:los caracoles terrestres se han desarrollado a partir de especies marinas, y tuvo que encontrar estrategias novedosas para hacer frente a las cargas más altas de metales pesados en el suelo. Los entornos aún más duros se encuentran en las orillas del mar con su suministro de agua fluctuante. Como descubrieron los científicos, el gasterópodo marino Littorina littorea (bígaro común), que ha colonizado con mucho éxito las costas del Atlántico norte, ha encontrado una estrategia peculiar para una desintoxicación aún más eficiente.
Estudiar las diferencias moleculares entre las proteínas entre varias especies, Los científicos resolvieron la estructura de la solución de la metalotioneína del bígaro utilizando técnicas de resonancia magnética nuclear y la compararon con otras estructuras y secuencias conocidas. Asombrosamente, La proteína de la vincapervinca comprende tres dominios independientes, mientras que otras metalotioneínas conocidas tienen sólo una o dos. Cada uno de los tres dominios contiene nueve residuos de cisteína que se unen a un grupo de tres iones de cadmio, por tanto, los 27 residuos de cisteína en total pueden incorporar nueve iones de cadmio. Esto arroja luz sobre la estrategia de adaptación:"Aumentar el número de dominios simplemente aumenta la capacidad de unión de metales de la proteína y, por lo tanto, potencia su capacidad de desintoxicación de metales, "escribieron los autores.
En cuanto a las características estructurales, el complejo formado con cadmio es muy similar al de la forma de caracol romano, que puede discriminar eficientemente entre los iones de cobre vitales para los caracoles y el cadmio tóxico. Y además de simplemente hacer frente a entornos ricos en cadmio y seleccionar el cobre de otros metales pesados, las metalotioneínas ricas en cisteína se consideran proteínas importantes de respuesta al estrés oxidativo. El estrés es uno de los principales encuentros del bígaro común, que puede sobrevivir a mares agitados y sequía al mismo tiempo.