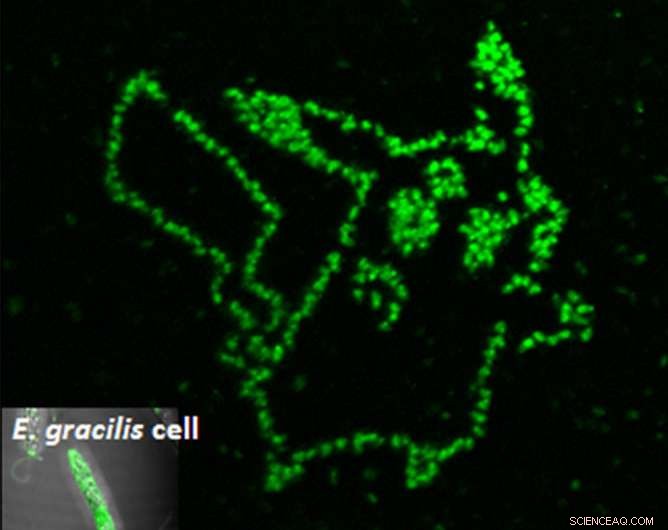
La fotoporación de un aptámero fluorogénico en células de microalgas individuales muestra exactamente dónde se encuentra el metabolito deseado. Crédito:Yoichiroh Hosokawa
En la búsqueda de nuevas fuentes de consumibles, los científicos se han dado cuenta de que la vida misma podría ser la solución. Los ingenieros metabólicos han alterado el metabolismo de los organismos vivos para producir nuevos fármacos, biodegradables y biocombustibles. Uno de los mejores ejemplos de los tiempos modernos es la penicilina. Las bacterias de ingeniería metabólica han mejorado la tasa de producción de este fármaco más de 100 veces.
Un gran desafío en este campo es identificar qué células son las más productivas. Es relativamente fácil estudiar poblaciones a granel, lo que da como resultado información sobre el metabolismo de la población celular en general. Sin embargo, sigue siendo extremadamente difícil identificar qué células de la población general se destacan por encima del resto en términos de producción de metabolitos y, por lo tanto, son las mejores para copiar e imitar. Esta identificación requiere observar los procesos internos de las células individuales en tiempo real mientras se produce el metabolito. Los científicos del Instituto de Ciencia y Tecnología de Nara (NAIST) informan sobre un nuevo sistema que logra este objetivo en las células de microalgas. El sistema combina aptámeros fluorogénicos con fotoporación láser de femtosegundos. El estudio se publica en Informes científicos .
"Las algas tienen una serie de cualidades atractivas para la ingeniería metabólica. Primero, son extremadamente adaptables, ya que tienen la capacidad de vivir en una amplia gama de entornos, desde el ecuador hasta los polos e incluso en aguas muy salinas o contaminadas, "dice el profesor Yoichiroh Hosokawa, quien dirigió el estudio.
Normalmente, Los científicos utilizan la microscopía de fluorescencia para observar el interior de una célula. Esta estrategia implica unir una molécula que presenta fluorescencia al metabolito de interés. Sin embargo, debido a la protección de la pared celular, Ha sido difícil introducir moléculas fluorescentes que detecten metabolitos específicos en células de microalgas desde el exterior.
Por lo tanto, el equipo de Hosokawa ha estado desarrollando aptámeros fluorescentes que emiten fluorescencia al unirse al metabolito paramilón y métodos de fabricación que pueden introducirlos en la célula mediante pulsos de láser.
"Sintetizamos un aptámero peptídico que se une al paramilón, y lo introdujo en células de Euglena gracilis mediante procesamiento láser de una sola célula, "dijo el Dr. Takanori Maeno, quién fue el primer autor del estudio. "El paramilón es producido únicamente por Euglena y funciona como fibra. Puede refinarse en biocombustibles, "añadió.
Para meter el aptámero dentro de la celda, los científicos dispararon a las células con pulsos de láser de solo femtosegundos de duración. Estos pulsos crearon poros temporales lo suficientemente grandes para que entren los aptámeros. Una vez dentro, las celdas se volvieron verdes solo en los lugares donde los aptámeros se unían al paramilón. Usando esta técnica, El grupo de Hosokawa pudo medir la acumulación de paramilón con el tiempo, discriminando así las células eficientes de sus vecinas improductivas.
Si bien el sistema solo se probó en paramilón, Hosokawa afirma que otros metabolitos serán detectables con aptámeros apropiados.
"Nuestro método proporciona información espacial y temporal sobre el paramilón intracelular objetivo, pero debería funcionar para cualquier tipo de metabolito en el futuro. Será útil para seleccionar celdas de alto rendimiento, " él dijo.