Un grupo de investigadores ha ampliado el conocimiento convencional sobre una enzima crítica que controla la migración celular. En una publicación en la revista Nature Communications , informaron que la fosfoinositida 3-quinasa (PI3K) no solo actúa como un acelerador para estimular la motilidad celular, sino que también tiene un mecanismo de freno incorporado que impide la migración.
"PI3K es una enzima de señalización importante que se ha estudiado ampliamente durante más de 30 años debido a su papel en funciones celulares fundamentales como el crecimiento, la supervivencia, el movimiento y el metabolismo", dice Hideaki Matsubayashi, autor principal del estudio y profesor asistente en Frontier de la Universidad de Tohoku. Instituto de Investigación en Ciencias Interdisciplinarias (FRIS).
"Desempeña un papel fundamental en la migración e invasión celular, algo que, cuando se desregula, puede causar muchas patologías. Nuestro trabajo reveló que PI3K también puede restringir activamente estos mismos procesos migratorios a través de un mecanismo endocítico no catalítico separado que se origina en su subunidad p85β. "
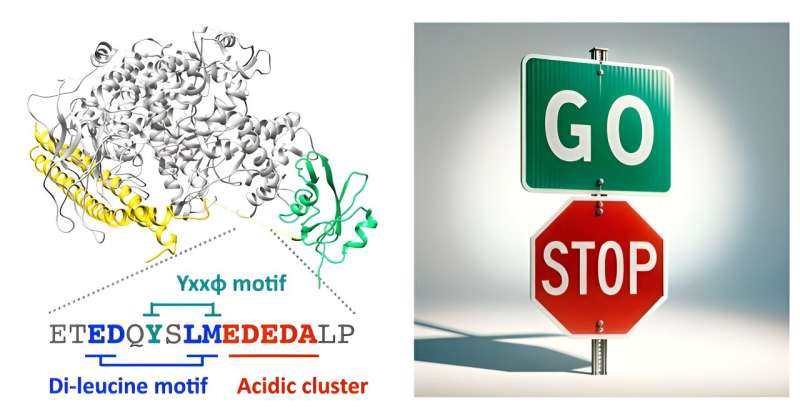
Utilizando una combinación de bioinformática, modelado molecular, ensayos de unión bioquímica e imágenes de células vivas, Matsubayashi y sus colegas demuestran que una región desordenada dentro del dominio inter-SH2 de p85β se une directamente a la proteína endocítica AP2. Esta parte de PI3K puede activar un proceso celular que atrae ciertas moléculas hacia la célula, y lo hace sin necesidad de la función típica de modificación de lípidos de la enzima.
Cuando los investigadores interrumpieron la unión, el p85β mutado no funcionó como debería. En lugar de regular el movimiento celular a través de su mecanismo de freno, se acumuló en sitios específicos dentro de la célula. Esto hace que las células se muevan más rápido y de manera más persistente, lo que indica una pérdida del control del mecanismo de freno sobre la migración celular.
"Sorprendentemente, esta única enzima PI3K tiene pedales opuestos de acelerador y freno integrados en su estructura molecular", añade Matsubayashi. "El mecanismo endocítico ayuda a regular la actividad de PI3K para garantizar que el movimiento celular se controle en el momento y lugar adecuados para procesos biológicos importantes".
Se descubrió que esta función de frenado era específica únicamente de la subunidad p85β. Y dado que la subunidad p85β de PI3K está relacionada con propiedades promotoras del cáncer, una comprensión más profunda de la regulación de PI3K y su especificidad de isoforma podría conducir a nuevas estrategias terapéuticas, como aquellas que inhiben selectivamente el aspecto canceroso de PI3K mientras preservan las funciones normales de PI3K. en células sanas.
Más información: Hideaki T. Matsubayashi et al, Papel no catalítico de la fosfoinositida 3-quinasa en la migración de células mesenquimales mediante la inducción no canónica de la endocitosis mediada por p85β/AP2, Nature Communications (2024). DOI:10.1038/s41467-024-46855-y
Información de la revista: Comunicaciones sobre la naturaleza
Proporcionado por la Universidad de Tohoku