Uno de los muchos secretos del éxito de las bacterias es su capacidad para defenderse de los virus, llamados fagos, que infectan las bacterias y utilizan su maquinaria celular para hacer copias de sí mismas.
Los avances tecnológicos han permitido la identificación reciente de las proteínas involucradas en estos sistemas, pero los científicos aún están profundizando en lo que hacen esas proteínas.
En un nuevo estudio, un equipo de la Universidad Estatal de Ohio ha informado sobre el ensamblaje molecular de uno de los sistemas antifagos más comunes, de la familia de proteínas llamada Gabija, que se estima que es utilizado por al menos un 8,5%, y hasta el 18% de todas las especies de bacterias de la Tierra.
Los investigadores descubrieron que una proteína parece tener el poder de defenderse de un fago, pero cuando se une a una proteína asociada, el complejo resultante es muy hábil para cortar el genoma de un fago invasor para impedirle replicarse.
"Creemos que las dos proteínas necesitan formar el complejo para desempeñar un papel en la prevención de fagos, pero también creemos que una proteína por sí sola tiene alguna función antifagos", dijo Zhangfei Shen, coautor principal del estudio y académico postdoctoral. en química biológica y farmacología de la Facultad de Medicina del Estado de Ohio. "Es necesario estudiar más a fondo el papel de la segunda proteína."
Los hallazgos contribuyen a la comprensión científica de las estrategias evolutivas de los microorganismos y algún día podrían traducirse en aplicaciones biomédicas, afirman los investigadores.
Shen y el coautor principal Xiaoyuan Yang, Ph.D. estudiante, trabajo en el laboratorio del autor principal Tianmin Fu, profesor asistente de química biológica y farmacología en el estado de Ohio.
El estudio fue publicado el 16 de abril en Nature Structural &Molecular Biology. .

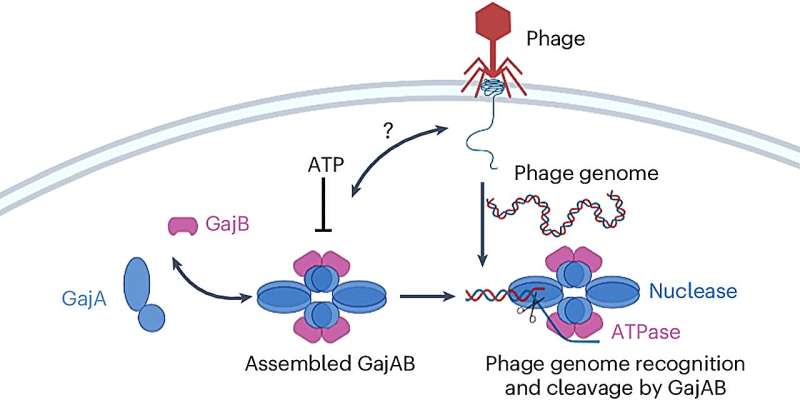
Las dos proteínas que componen este sistema de defensa se llaman Gabija A y Gabija B, o GajA y GajB para abreviar.
Los investigadores utilizaron microscopía crioelectrónica para determinar las estructuras bioquímicas de GajA y GajB individualmente y de lo que se llama un complejo supramolecular, GajAB, creado cuando los dos se unen para formar un grupo que consta de cuatro moléculas de cada proteína.
En experimentos utilizando la bacteria Bacillus cereus como modelo, los investigadores observaron la actividad del complejo en presencia de fagos para comprender mejor cómo funciona el sistema de defensa.
Aunque GajA por sí solo mostró signos de actividad que podrían desactivar el ADN de un fago, el complejo que formó con GajB fue mucho más efectivo para garantizar que los fagos no pudieran apoderarse de la célula bacteriana.
"Esa es la parte misteriosa", dijo Yang. "GajA por sí solo es suficiente para escindir el núcleo del fago, pero también forma el complejo con GajB cuando los incubamos juntos. Nuestra hipótesis es que GajA reconoce la secuencia genómica del fago, pero GajB mejora ese reconocimiento y ayuda a cortar el ADN del fago. "
El gran tamaño y la configuración alargada del complejo dificultaron obtener una imagen completa de las contribuciones funcionales de GajB cuando se une a GajA, dijo Shen, dejando al equipo hacer algunas suposiciones sobre las funciones de las proteínas que aún no se han confirmado.
"Solo sabemos que GajB ayuda a mejorar la actividad de GajA, pero aún no sabemos cómo funciona porque solo vemos alrededor del 50% en el complejo", dijo Shen.
Una de sus hipótesis es que GajB puede influir en el nivel de concentración de una fuente de energía, el nucleótido ATP (trifosfato de adenosina), en el entorno celular, específicamente, reduciendo el ATP al detectar la presencia del fago. Eso tendría el doble efecto de expandir la actividad de desactivación del ADN del fago de GajA y robar la energía que un fago necesitaría para comenzar a replicarse, dijo Yang.
Hay más que aprender sobre los sistemas de defensa antifagos bacterianos, pero este equipo ya ha demostrado que bloquear la replicación del virus no es la única arma en el arsenal bacteriano. En un estudio anterior, Fu, Shen, Yang y sus colegas describieron una estrategia de defensa diferente:las bacterias programan su propia muerte en lugar de dejar que los fagos se apoderen de una comunidad.
Más información: Xiao-Yuan Yang et al, Base molecular de los ensamblajes supramoleculares antifagos de Gabija, Nature Structural &Molecular Biology (2024). DOI:10.1038/s41594-024-01283-w
Información de la revista: Naturaleza Biología estructural y molecular
Proporcionado por la Universidad Estatal de Ohio