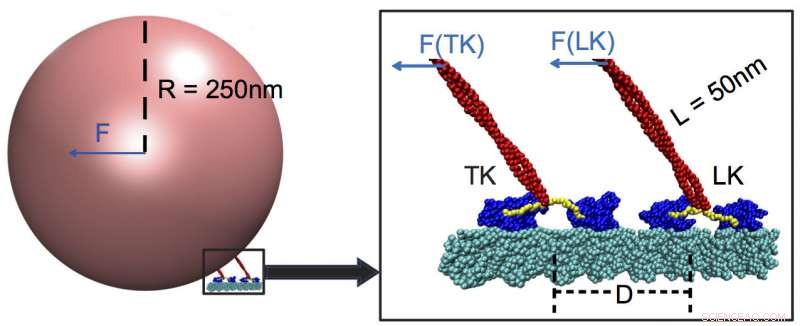
Dos kinesinas que soportan carga mientras transportan carga a lo largo de un microtúbulo (cian). Los investigadores de la Universidad Rice y la Universidad de Houston determinaron que las proteínas motoras responden mejor a las fuerzas fuertes y casi nada a las débiles. incluso los aplicados por motores acoplados a la misma carga. En este ejemplo, la kinesina principal (LK) lleva la mayor parte de la carga, con cabezales de motor (azul) activados por un conector de cuello (amarillo) que se conecta al tallo (rojo) y detecta la presencia de la carga. Crédito:Centro de Física Biológica Teórica / Universidad de Rice
Si eres la proteína motora desde el principio, prepárate para tirar con fuerza.
Esa es una conclusión de un estudio dirigido por la Universidad de Rice sobre los mecanismos que impulsan las quinesinas, proteínas motoras que transportan carga dentro de las células. El estudio muestra que se necesita mucha fuerza para frenar una determinada kinesina. La proteína tampoco recibe mucha ayuda de los colegas que están detrás.
El estudio teórico detallado en el procedimientos de la Academia Nacional de Ciencias y dirigido por el investigador postdoctoral de Rice, Qian Wang, fue un esfuerzo de colaboración de los laboratorios de tres profesores de Rice y uno de la Universidad de Houston, todos trabajando bajo el paraguas del Centro de Rice de Física Biológica Teórica (CTBP).
Esperan aumentar el conocimiento sobre los caballos de batalla poco entendidos dentro de las células que son fundamentales para la división celular y el transporte de carga. Las cinesinas defectuosas o deficientes están implicadas en la enfermedad de Charcot-Marie-Tooth y en algunas enfermedades renales.
A través de simulaciones por computadora, Los investigadores proporcionan los primeros detalles a nivel molecular de cómo las quinesinas responden a las fuerzas externas al tiempo que confirman experimentos anteriores del coautor Michael Diehl que demostraron que los equipos de quinesinas funcionan mejor solo cuando están muy cerca y pueden tirar en la misma dirección.
"Comprendemos más o menos los motores individuales, "dijo el biofísico y coautor de Rice, Anatoly Kolomeisky, cuya investigación anterior mostró que las proteínas motoras son sensibles a la presencia de otras. "En naturaleza, trabajan en equipo, pero debido a que los motores responden relativamente débilmente a un rango significativo de fuerzas, sostenemos que esta es la razón principal por la que las kinesinas no siempre cooperan entre sí ".
Las kinesinas transforman la energía del químico ATP, o trifosfato de adenosina, en acción mecánica. Se adhieren a grandes cargas como mitocondrias o cromosomas y los arrastran a lo largo de los filamentos citoesqueléticos hasta los confines de una célula. Cada kinesina contiene dos subunidades "principales", y cada subunidad contiene dos sitios de unión:uno para agarrar y caminar a lo largo de los microtúbulos y el otro para unir ATP.
Los modelos mostraron kinesinas, una familia de moléculas motoras descubiertas en 1985, son "débilmente susceptibles" a las fuerzas externas pequeñas o medianas y atraen su carga a través de una oposición muy fuerte. Entre las fuerzas débiles se encuentran las aplicadas por las kinesinas arrastradas adheridas a la misma carga.
Resulta que estos compañeros de equipo apenas se registran con el jefe kinesin si están a más de 48 nanómetros de distancia. Cuando ese es el caso, la quinesina de plomo transporta más del 90 por ciento de la carga.
Las simulaciones de Rice revelaron que el líder presta más atención al tirón de la carga en sí, que activa un "interruptor" en el enlazador del cuello, parte del tallo que tira de la carga como una cuerda en un globo. El enlazador acopla la carga a los sitios de unión de ATP de los motores de cabeza, que a su vez controla la velocidad. Una kinesina que se arrastra demasiado lejos no siente la fuerza y, por lo tanto, no puede contribuir con su músculo.
"Cuando el motor está en movimiento, el conector del cuello se tensa, "dijo el biofísico de Rice José Onuchic, coautor y codirector del CTBP. "Si ese enlazador no está tenso, el motor pierde velocidad porque no puede tomar una decisión por sí solo. Esta competencia entre la tensión y la unión al microtúbulo es necesaria para garantizar la procesividad de este motor ".
La simulación base permitirá a los investigadores probar más kinesinas que mueven la carga desde el núcleo hasta los límites exteriores de la célula y, finalmente, dineínas, proteínas más grandes y complejas que mueven la carga hacia el centro.
"Tienes que hacer este primer paso muy bien y con muchos detalles para ganar confianza antes de enfrentarte a una bestia como la dineína, "Dijo Diehl." Estos muchachos han trabajado muy duro durante años a través de múltiples estudios y se han unido, colectivamente, una forma de enumerar y analizar las transiciones entre los pasos clave de este proceso mecánico.
"Ahora, ser capaz de adoptar ese enfoque para un motor como la dineína tiene la oportunidad de explicar muchas cosas importantes, misterios fundamentales sobre cómo funciona una proteína de ese complejo, " él dijo.
"Es el tipo de estudio que a un solo investigador principal le resultaría difícil realizar, "Dijo Onuchic." Para problemas que son tan complicados, es bueno tener esta combinación de talento ".