Puede buscar una imagen de un átomo en Internet y encontrará una, aunque nadie haya visto un átomo antes. Pero tenemos una estimación de cómo se ve un solo átomo debido al trabajo de un grupo de científicos diferentes como el físico danés Niels Bohr.
Los átomos son los componentes básicos de la materia:un solo átomo de cualquier elemento individual es la entidad más básica de la naturaleza que aún se rige por las reglas de la física que podemos observar en la vida cotidiana (las partículas subatómicas que forman los átomos tienen sus propias reglas especiales) . Los científicos sospecharon que los átomos existieron durante mucho tiempo antes de que pudieran conceptualizar su estructura; incluso los antiguos griegos pensaban que la materia del universo estaba formada por componentes tan pequeños que no podían descomponerse en nada más pequeño. y llamaron a estas unidades fundamentales atomos , que significa "indiviso". A finales del siglo XIX, se entendía que las sustancias químicas podían descomponerse en átomos, que eran muy pequeños y los átomos de diferentes elementos tenían un peso predecible.
Pero entonces, en 1897, El físico británico J.J. Thomson descubrió los electrones, partículas cargadas negativamente dentro de los átomos que todos habían pasado la mayor parte de un siglo creyendo que eran completamente indivisibles, como las cosas más pequeñas que existían. Thomson acaba de plantear la hipótesis de que existían los electrones, pero no pudo averiguar exactamente cómo encajan los electrones en un átomo. Su mejor suposición fue el "modelo de pudín de ciruela, "que representaba al átomo como un pastel cargado positivamente tachonado de áreas cargadas negativamente esparcidas por todas partes como frutas en un postre antiguo.
"Se encontró que los electrones eran eléctricos negativos, y todos con la misma masa y muy pequeños en comparación con los átomos, "dice Dudley Herschbach, un químico de Harvard que compartió el Premio Nobel de Química en 1986 por sus "contribuciones sobre la dinámica de los procesos químicos elementales, "en un correo electrónico". Ernest Rutherford descubrió el núcleo en 1911. Los núcleos eran eléctricos positivos, con varias masas pero mucho más grandes que los electrones, pero de tamaño muy pequeño ".
Niels Bohr fue un alumno de Rutherford que se hizo cargo valientemente del proyecto de su mentor de descifrar la estructura del átomo en 1912. Le tomó solo un año crear un modelo funcional de un átomo de hidrógeno.
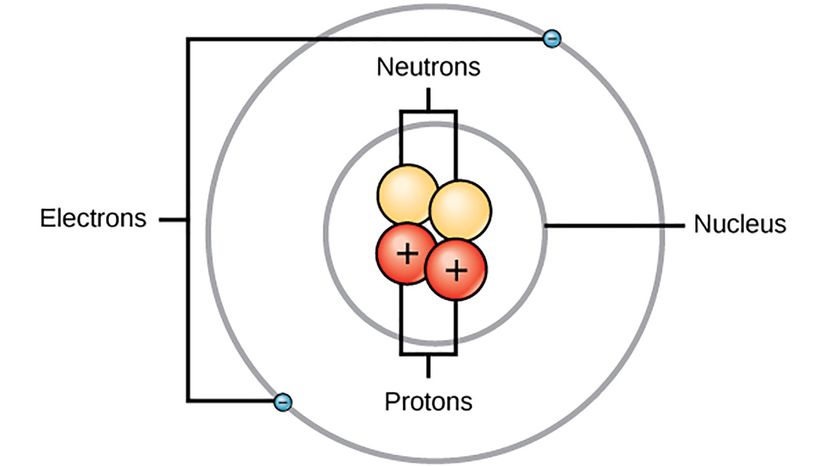
"El modelo de Bohr de 1913 para el átomo de hidrógeno tenía órbitas de electrones circulares alrededor del protón, como las órbitas de la Tierra alrededor del sol, "dice Herschbach." Bohr había hecho uso de un patrón simple y regular para el espectro del átomo de hidrógeno, que había sido encontrado por Johann Balmer en 1885. También hizo uso de la idea de la idea cuántica, encontrado por Max Planck en 1900 ".
En 1913, El modelo de Bohr fue un gran paso adelante porque incorporó características de la mecánica cuántica recién nacida en la descripción de átomos y moléculas. Ese año, publicó tres artículos sobre la constitución de átomos y moléculas:el primero y más famoso estaba dedicado al átomo de hidrógeno y los otros dos describían algunos elementos con más electrones, utilizando su modelo como marco. El modelo que propuso para el átomo de hidrógeno tenía electrones moviéndose alrededor del núcleo, pero solo en pistas especiales con diferentes niveles de energía. Bohr planteó la hipótesis de que la luz se emitía cuando un electrón saltaba de una pista de mayor energía a una pista de menor energía; eso es lo que hacía que el hidrógeno brillara en un tubo de vidrio. Él tiene el hidrógeno correcto pero su modelo tenía un poco de fallas.
"El modelo no pudo predecir el valor correcto de las energías del estado fundamental de los átomos de muchos electrones y las energías de enlace de las moléculas, incluso para los sistemas más simples de 2 electrones, como el átomo de helio o una molécula de hidrógeno, "dice Anatoly Svidzinsky, profesor en el Instituto de Ciencia e Ingeniería Cuántica de Texas A&M, en una entrevista por correo electrónico. "Entonces, ya en 1913, estaba claro que el modelo de Bohr no es del todo correcto. Incluso para el átomo de hidrógeno, El modelo de Bohr predice incorrectamente que el estado fundamental del átomo posee un momento angular orbital distinto de cero ".
Cuales, por supuesto, puede que no tenga mucho sentido para ti si no eres un físico cuántico. Sin embargo, El modelo de Bohr se aceleró para recibir un Premio Nobel de Física en 1922. Pero incluso cuando Bohr estaba cimentando su reputación en el mundo de la física, los científicos estaban mejorando su modelo:
"El modelo de Bohr para el átomo de hidrógeno fue mejorado por Arnold Sommerfeld en 1916, "dice Herschbach." Encontró órbitas elípticas que representaban líneas espectrales cercanas a las que habían venido de órbitas circulares. El modelo de Bohr-Sommerfeld para el átomo de hidrógeno es básico, pero la cuántica y la relatividad se convirtieron en aspectos importantes ".
Entre 1925 y 1928, Werner Heisenberg, Max Born, Wolfgang Pauli, Erwin Schrodinger y Paul Dirac desarrollaron estos aspectos mucho más allá del modelo atómico de Bohr, pero el suyo es, con mucho, el modelo de átomo más reconocido. Los modelos atómicos que nos ha dado la física cuántica se parecen menos a un sol rodeado de planetas de electrones y más al arte moderno. Es probable que todavía usemos el modelo de Bohr porque es una buena introducción al concepto de átomo.
"En 1913, El modelo de Bohr demostró que la cuantificación es un camino correcto a seguir en la descripción del micromundo, "dice Svidzinsky." Por lo tanto, El modelo de Bohr mostró a los científicos una dirección para buscar y estimuló un mayor desarrollo de la mecánica cuántica. Si conoces el camino luego, tarde o temprano, encontrará la solución adecuada al problema. Uno puede pensar en el modelo de Bohr como una de las señales de dirección a lo largo de una ruta de senderismo hacia el mundo cuántico ".
Eso es interesanteEl padre de Niels Bohr, Christian Bohr, fue nominado a tres premios Nobel diferentes en Fisiología de la Medicina, aunque nunca ganó.