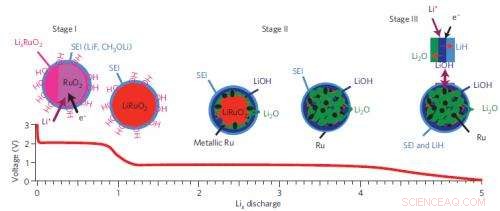
Un resumen de la ruta de reacción de tres etapas del sistema de batería de óxido de rutenio-litio.
Las baterías de iones de litio (Li) alimentan casi todos los dispositivos electrónicos portátiles que usamos todos los días, incluidos los teléfonos inteligentes, cámaras, juguetes e incluso coches eléctricos. Investigadores de todo el mundo están trabajando para encontrar materiales que conduzcan a barato, duradero, y potentes baterías de iones de litio.
Trabajando en varias instalaciones de fuentes de luz del Departamento de Energía de EE. UU. Y en las universidades de Cambridge y Stony Brook, un grupo de investigadores estudió recientemente una clase de electrodos de baterías de iones de litio que tienen capacidades mucho mayores que las de los materiales utilizados en las baterías actuales. Los investigadores querían determinar por qué estos materiales a menudo pueden almacenar más carga de lo que predice la teoría.
Los autores eligieron óxido de rutenio (RuO2) como sistema modelo para estudiar estos llamados "materiales de conversión, "nombrados porque sufren grandes cambios estructurales cuando reaccionan con iones de litio, formando de forma reversible nanopartículas y sales metálicas (aquí Ru y Li2O). Estas reacciones son muy diferentes a las que ocurren en los electrodos convencionales, que almacenan carga al permitir que los iones de Li se aniden en espacios dentro de la red cristalina.
"Nuestra investigación identificó la fuente de la capacidad adicional encontrada para RuO2, y también ha producido un protocolo para estudiar la 'capa de pasivación' que se forma en los electrodos de la batería, que protege al electrolito de sufrir más reacciones de descomposición en los ciclos de carga-descarga posteriores, "dijo el investigador correspondiente del estudio, Clare Grey, profesor en los departamentos de química de las universidades de Cambridge y Stony Brook. "Comprender las estructuras de estas capas de pasivación es clave para fabricar baterías que duren lo suficiente para su uso en aplicaciones como el transporte y el almacenamiento de la red eléctrica".
En la fuente de luz de sincrotrón nacional del Laboratorio Nacional de Brookhaven, El equipo estudió sus muestras utilizando una estructura cercana al borde de absorción de rayos X (XANES) y una estructura fina de absorción de rayos X extendida (EXAFS). En la fuente de fotones avanzada en el laboratorio nacional de Argonne, utilizaron dos técnicas adicionales, análisis de difracción de rayos X de alta resolución (XRD) y función de distribución de par de dispersión (PDF), para extraer información sobre los cambios estructurales electrónicos y de largo / corto alcance del electrodo RuO2 en tiempo real a medida que se descargaba y cargaba la batería. Usando estos métodos, el equipo demostró que RuO2 se redujo a nanopartículas de Ru y Li2O a través de la formación de fases intermedias, LixRuO2.
Dado que esto no explica la fuente del mecanismo de almacenamiento de carga adicional, el grupo utilizó otra técnica, resonancia magnética nuclear de estado sólido (RMN) de alta resolución. Este método implica someter una muestra a un campo magnético y medir la respuesta de los núcleos dentro de la muestra. Puede proporcionar información específica sobre las composiciones químicas y las estructuras locales, y es particularmente útil para estudiar compuestos que contienen solo elementos "ligeros", como el hidrógeno (H), Li, y oxígeno (O), que son difíciles de detectar usando XRD. Los datos de RMN mostraron que el principal contribuyente a la capacidad es la formación de LiOH, que se convierte reversiblemente en Li2O y LiH. Los contribuyentes menores a la capacidad provienen del almacenamiento de Li en las superficies de nanopartículas de Ru, formando una aleación LixRu, y la descomposición del electrolito. El último, sin embargo, en última instancia, hace que la capacidad disminuya y resultará en la muerte de la batería después de múltiples ciclos de carga.