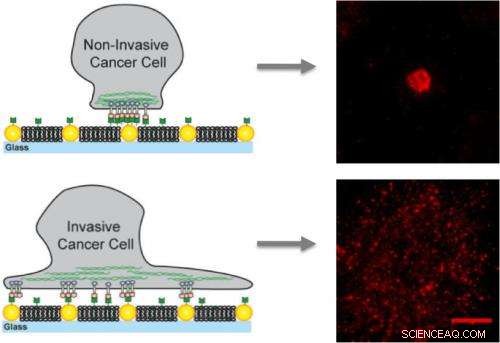
En membranas artificiales incrustadas con nanopuntos de oro, Las células cancerosas no invasivas se unen solo a los nanodots y quedan inmovilizadas, mientras que las células invasoras se unen a la membrana y a los nanodots creando grupos móviles que contribuyen a la metástasis.
(Phys.org) —Aumenta la evidencia de que el desarrollo y la propagación del cáncer, atribuido durante mucho tiempo a la expresión génica y la señalización química que salió mal, también implica un componente biomecánico. Investigadores del Laboratorio Nacional Lawrence Berkeley (Berkeley Lab) se han sumado a este cuerpo de evidencia al demostrar que la actividad maligna de un sistema proteico celular crítico puede surgir de lo que esencialmente son atascos de tráfico de proteínas.
Usando una membrana artificial única imbuida con una carrera de obstáculos de nanodots de oro, un equipo de investigación dirigido por el químico Jay Groves estudió el transporte del complejo de señalización de proteínas EphA2 / efrina-A1 a través de las superficies de 10 líneas celulares de cáncer epitelial de mama diferentes que muestran una amplia gama de características de la enfermedad. Los investigadores encontraron que el transporte de este complejo receptor-ligando era normal en las líneas celulares más saludables, pero se atascaba en las líneas celulares enfermas. con el peor atasco teniendo lugar en las celdas que estaban más enfermas.
"Hay algo en la fuerza con que se agrupan las proteínas EphA2 en la superficie celular que está relacionado e incluso puede contribuir al comportamiento maligno de las células cancerosas". "Dice Groves." El bloqueo diferencial del transporte de EphA2 entre las diversas líneas celulares de cáncer de mama y su correlación con las características de la enfermedad sugiere que la agrupación de EphA2 en sí misma puede contribuir a los efectos patológicos ".
Groves tiene nombramientos conjuntos con la División de Biociencias Físicas de Berkeley Lab y el Departamento de Química de UC Berkeley, y también es investigador del Instituto Médico Howard Hughes (HHMI). Es el autor correspondiente de un artículo que describe esta investigación en la revista Nano letras titulado "Las matrices de obstáculos a nanoescala frustran el transporte de agrupaciones de EphA2 / efrina-A1 en líneas celulares cancerosas". Los coautores de este artículo fueron Theobald Lohmuller y Qian Xu.
EphA2 pertenece a una familia de enzimas que son reguladores clave de los procesos celulares. Ephrin-A1 es una proteína de señalización que se une a EphA2. Los complejos de EphA2 / ephrin-A1 se reunirán en grupos que luego se transportan a través de la superficie celular. La sobreexpresión de EphA2 se ha relacionado con varios cánceres humanos, pero es especialmente prominente en el cáncer de mama.
"Alrededor del 40 por ciento de todos los pacientes con cáncer de mama muestran una sobreexpresión de EphA2 que se correlaciona con la metástasis tumoral, como consecuencia, Se ha dedicado mucho esfuerzo al desarrollo de terapias dirigidas a EphA2, "Dice Groves". Sin embargo, Precisamente qué sale mal con EphA2 que contribuye al comportamiento celular patológico sigue sin estar claro, ya que EphA2 generalmente no está mutado en células cancerosas ".
Groves es una autoridad líder en el campo emergente de la mecanobiología, que busca comprender cómo las células perciben y responden a las fuerzas mecánicas. Para investigar un posible factor mecánico en el vínculo de EphA2 con el cáncer de mama, Groves utilizó una técnica que desarrolló su grupo en la que las membranas artificiales formadas por una bicapa fluida de moléculas de lípidos están incrustadas con matrices fijas de nanopuntos de oro. Esto permite a los investigadores controlar el espaciamiento o transporte de proteínas y otras moléculas celulares colocadas en las membranas.
Para este estudio, Groves y sus colegas utilizaron matrices de nanodots de oro para presentar obstáculos definidos para el movimiento y ensamblaje de los cúmulos de EphA2 / ephrin-A1. Los ligandos de efrina-A1 podrían unirse a la membrana, lo que permitió que los clústeres fueran móviles, o a los nanodots, que inmovilizó los racimos, o para ambos. Los investigadores trabajaron con líneas de células de cáncer de mama que tienen niveles similares de expresión de EphA2 e incluyeron MDA-MB-231, una línea altamente invasiva y tumorigénica, y MCF10A, una línea relativamente benigna y no tumorígena.
"Cuando vemos células que tienen los mismos niveles de EphA2 pero el MDA-MB-231 está bloqueado mientras que el MCF10A no, entonces podemos decir que es algo más allá de los números de EphA2 lo que importa, algo sobre la forma en que EphA2 está conectado al resto de la celda que está mal relacionado, "Dice Groves." Nuestras observaciones sugieren que el citoesqueleto es el culpable y que los fármacos que modulan el citoesqueleto también podrían modular terapéuticamente la agrupación de EphA2, reduciendo así el comportamiento patológico ".