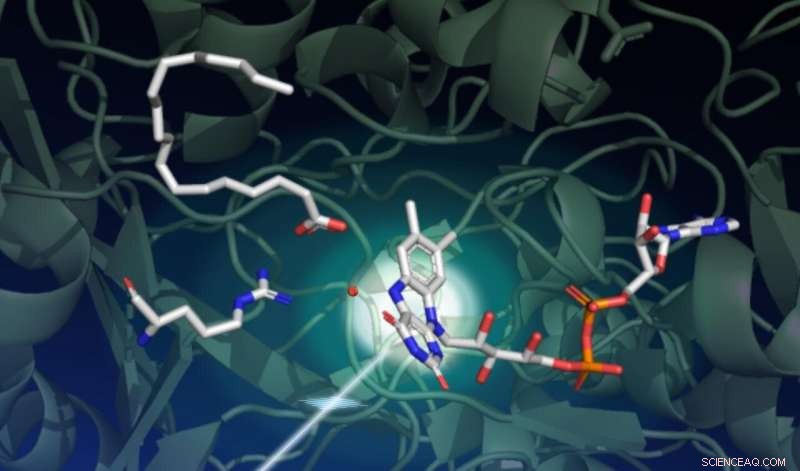
Un estudio que utilizó el láser de rayos X LCLS de SLAC capturó cómo la luz impulsa una serie de cambios estructurales complejos en una enzima llamada FAP, que cataliza la transformación de ácidos grasos en ingredientes de partida para disolventes y combustibles. Este dibujo captura el estado inicial de la reacción catalítica. El fondo verde oscuro representa el andamio de proteínas. La parte sensible a la luz de la enzima, llamado cofactor FAD, se muestra en el centro a la derecha con sus tres anillos que absorben un fotón que viene de abajo a la izquierda. Un ácido graso en la parte superior izquierda espera su transformación. El aminoácido que se muestra en el medio a la izquierda juega un papel importante en el ciclo catalítico, y el punto rojo cerca del centro es una molécula de agua. Crédito:Damien Sorigue / Universite Aix-Marseille
Aunque muchos organismos capturan y responden a la luz solar, las enzimas, proteínas que catalizan reacciones bioquímicas, rara vez son impulsadas por la luz. Hasta ahora, los científicos han identificado solo tres tipos de fotoenzimas naturales. El más nuevo, descubierto en 2017, es la fotodecarboxilasa de ácido graso (FAP). Derivado de algas microscópicas, utiliza luz azul para catalizar la conversión de ácidos grasos, que se encuentra en grasas y aceites, en alcanos y alquenos.
"Un número creciente de laboratorios prevé el uso de FAP para aplicaciones de química ecológica, porque los alcanos y alquenos son componentes importantes de disolventes y combustibles, incluyendo gasolina y combustibles para aviones. Y la transformación de ácidos grasos en alcanos o alquenos ocurre en un solo paso dentro de la enzima, "dice Martin Weik, líder de un grupo de investigación en el Instituto de Biología Structurale de la Universite Grenoble Alpes.
Weik es un investigador principal de un nuevo estudio que ha capturado la compleja secuencia de cambios estructurales que sufre la FAP en respuesta a la luz. llamado fotociclo, que impulsa esta transformación de ácidos grasos. Aunque los investigadores propusieron previamente un fotociclo FAP, no se entendió el mecanismo fundamental. Los científicos no sabían cuánto tardaba un ácido graso en perder su carboxilato, el grupo químico unido al final de su larga cadena de hidrocarburos, un paso crítico en la formación de alquenos o alcanos.
En colaboración con científicos de SLAC, Los experimentos en la Fuente de Luz Coherente Linac (LCLS) en el Laboratorio Nacional Acelerador SLAC del Departamento de Energía ayudaron a responder muchas de estas preguntas pendientes. Los investigadores describen sus resultados en Ciencias .
Todas las herramientas en una caja de herramientas
Para comprender una enzima sensible a la luz como FAP, Los científicos utilizan muchas técnicas diferentes para estudiar los procesos que tienen lugar en una amplia gama de escalas de tiempo, porque la absorción de fotones ocurre en femtosegundos, o millonésimas de mil millonésimas de segundo, mientras que las respuestas biológicas a nivel molecular a menudo ocurren en milésimas de segundo.
"Nuestro internacional, consorcio interdisciplinario, dirigido por Frederic Beisson en la Universite Aix-Marseille, utilizó una gran cantidad de técnicas, incluyendo espectroscopia, cristalografía y enfoques computacionales, "Dice Weik." Es la suma de estos resultados diferentes lo que nos permitió tener un primer vistazo de cómo funciona esta enzima única en función del tiempo y en el espacio ".
El consorcio estudió primero los pasos complejos del proceso catalítico en sus laboratorios domésticos utilizando métodos de espectroscopia óptica. que investigan la estructura electrónica y geométrica de los átomos en las muestras, incluyendo enlace químico y carga. Los experimentos espectroscópicos identificaron los estados intermedios de la enzima que acompañan a cada paso, midieron su vida útil y proporcionaron información sobre su naturaleza química. Estos resultados motivaron la necesidad de las capacidades ultrarrápidas del LCLS.
Próximo, Se proporcionó una vista estructural del proceso catalítico mediante cristalografía de femtosegundos en serie (SFX) con el láser de electrones libres de rayos X LCLS (XFEL). Durante estos experimentos, un chorro de diminutos microcristales de FAP se golpeó con pulsos de láser óptico para iniciar la reacción catalítica, seguido de extremadamente corto, Pulsos de rayos X ultrabrillantes para medir los cambios resultantes en la estructura de la enzima.
Al integrar miles de estas mediciones, adquiridas utilizando varios retrasos de tiempo entre los pulsos ópticos y de rayos X, los investigadores pudieron seguir los cambios estructurales en la enzima a lo largo del tiempo. También determinaron la estructura del estado de reposo de la enzima sondando sin el láser óptico.
Asombrosamente, los investigadores encontraron que en estado de reposo, la parte sensible a la luz de la enzima, llamado cofactor FAD, tiene una forma doblada. "Este cofactor actúa como una antena para capturar fotones. Absorbe la luz azul e inicia el proceso catalítico, ", Dice Weik." Pensamos que el punto de partida del cofactor FAD era plano, por lo que esta configuración doblada fue inesperada ".
La forma doblada del cofactor FAD fue descubierta por primera vez por cristalografía de rayos X en la Instalación Europea de Radiación Sincrotrón. pero los científicos sospecharon que esta curva era un artefacto de daño por radiación, un problema común para los datos cristalográficos recopilados en fuentes de luz de sincrotrón. Solo los experimentos SFX pudieron confirmar esta configuración inusual debido a su capacidad única para capturar información estructural antes de dañar la muestra. Dice Weik.
"Estos experimentos se complementaron con cálculos, " él añade, "Sin los cálculos cuánticos de alto nivel realizados por Tatiana Domratcheva de la Universidad Estatal de Moscú, no hubiéramos entendido nuestros resultados experimentales ".
Próximos pasos
A pesar de la mejor comprensión del fotociclo de FAP, Quedan preguntas sin respuesta. Por ejemplo, los investigadores saben que el dióxido de carbono se forma durante un cierto paso del proceso catalítico en un momento y lugar específicos, pero no conocen su estado cuando sale de la enzima.
"En el futuro trabajo de XFEL, queremos identificar la naturaleza de los productos y tomar fotografías del proceso con un tamaño de paso mucho más pequeño para resolver el proceso con mucho más detalle, ", dice Weik." Esto es importante para la investigación fundamental, pero también puede ayudar a los científicos a modificar la enzima para realizar una tarea para una aplicación específica ".