
El grupo de HPC "CARL" ayudó a descifrar el comportamiento de la molécula a través de extensos cálculos. Crédito:Daniel Schmidt / Universidad de Oldenburg
¿Cómo actúan los catalizadores moleculares, moléculas que, como enzimas, puede desencadenar o acelerar ciertas reacciones químicas:función, y que efectos tienen? Un equipo de químicos de la Universidad de Oldenburg se ha acercado a las respuestas utilizando una molécula modelo que funciona como una nanobatería molecular. Consiste en varios centros de titanio unidos entre sí por una sola capa de átomos de carbono y nitrógeno interconectados. El equipo de investigación de siete miembros publicó recientemente sus hallazgos, que combinan los resultados de tres Ph.D. proyectos de investigación, en ChemPhysChem . La revista de química física y física química incluyó en su portada la investigación básica de Oldenburg.
Para comprender mejor cómo funciona la molécula, los investigadores, encabezada por los primeros autores Dr. Aleksandra Markovic y Luca Gerhards y el autor correspondiente Prof.Dr. Gunther Wittstock, realizaron experimentos electroquímicos y espectroscópicos y utilizaron el grupo de computación de alto rendimiento de la universidad para sus cálculos. Wittstock ve la publicación del artículo como una "historia de éxito" tanto para los Grupos de Formación en Investigación dentro de los cuales el Ph.D. se llevaron a cabo proyectos y para el clúster de computación de la universidad. "Sin la infraestructura informática de alto rendimiento, no hubiéramos podido realizar los extensos cálculos necesarios para descifrar el comportamiento de la molécula, ", dice Wittstock. Esto subraya la importancia de tales clústeres de computación para la investigación actual".
En el papel, los autores presentan los resultados de su análisis de una estructura molecular, el prototipo fue el resultado de una reacción química inesperada reportada por primera vez por el Departamento de Química de la Universidad de Oldenburg en 2006. Es una estructura molecular altamente compleja en la que tres centros de titanio (comúnmente conocidos en las lecciones de secundaria como iones de titanio) están conectados entre sí mediante un ligando puente que consta de carbono y nitrógeno. Se esperaría que tal compuesto pudiera aceptar y liberar varios electrones a través del intercambio de electrones entre los centros metálicos, entre otras razones.
Obtener una comprensión adecuada de estos procesos es de particular interés no solo para la investigación básica, pero también para desencadenar o acelerar reacciones importantes en las que se transfiere más de un electrón. Tales reacciones siguen siendo un gran desafío en los sistemas técnicos, para el que todavía no existe una solución satisfactoria. "Muchos esfuerzos se centran actualmente en este objetivo, ", dice Wittstock. Un ejemplo es la tecnología de pilas de combustible, que requiere la transferencia simultánea de cuatro electrones a una molécula de oxígeno para lograr un flujo de electrones desde el hidrógeno al oxígeno, el explica. "Estas reacciones de varios electrones también tienen un gran potencial para ahorrar materiales o energía en la producción química".
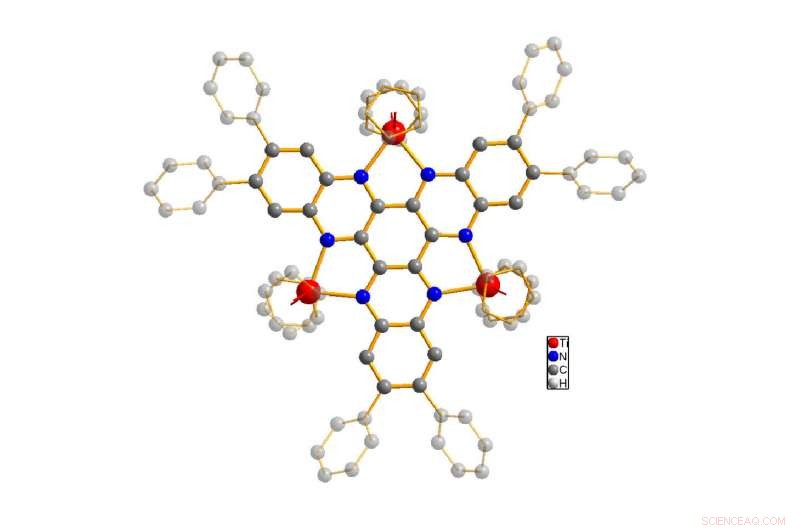
La estructura de la molécula en estudio (titanio en rojo, nitrógeno en azul, carbono en gris). Se destaca el cuerpo básico de la molécula, mientras que los átomos de hidrógeno están ocultos para simplificar. Crédito:Ruediger Beckhaus / Universidad de Oldenburg
El compuesto molecular modelo que consiste en el ligando puente y los centros de titanio fue diseñado específicamente para ayudar a los científicos a obtener una comprensión detallada de cómo los compuestos con varios centros metálicos pueden aceptar y liberar electrones. Los científicos excitaron la molécula con la luz, a lo que las moléculas respondieron de manera diferente dependiendo del número de electrones aceptados y liberados. Desafortunadamente, la molécula fabricada en 2006 demostró ser poco soluble en la mayoría de los disolventes y, por tanto, difícil de estudiar. Usando síntesis química, Dra. Pia Sander, un coautor del artículo, añadió motivos moleculares de tipo hélice al compuesto para mejorar su solubilidad. Esto proporcionó la base para los experimentos de Markovic, lo que reveló que el compuesto modelo podría aceptar un total de tres electrones o liberar seis electrones, una capacidad inusualmente alta para una sola molécula. En cada una de estas reacciones, no solo cambia el color visible de la molécula, sino la absorción de luz en los rangos espectrales que son invisibles para el ojo humano. Inicialmente, sin embargo, los cambios precisos en la molécula con diferentes números de electrones no pudieron determinarse sobre la base de esos rangos espectrales.
Aquí es donde entraron en juego Luca Gerhards y el grupo de computación de la universidad. Aunque las explicaciones comunes se basan en la premisa de que en cada transición excitada por la luz solo cambia la energía de un solo electrón, El coautor Gerhards evitó estos supuestos simplificadores en sus ecuaciones químicas cuánticas. Esto hizo que los cálculos fueran aún más complejos y mantuvo ocupado al clúster de computación de alto rendimiento durante meses. En el final, el resultado fue una sorpresa para todos los involucrados:varios electrones cambian sus niveles de energía simultáneamente cuando la luz golpea la molécula en estudio. Es más, esta carga no se almacena en el titanio, como era de esperar, pero principalmente en el ligando puente, el "vínculo" entre los centros de titanio.
Como explica Wittstock, los centros metálicos proporcionan así un "marco" cargado positivamente para el almacenamiento de electrones, como en una "nanobatería". La molécula modelo, y por extensión toda una clase de compuestos similares, ha resultado ser un "minisegmento de un material de almacenamiento de energía". Aunque no se puede determinar todo su potencial en esta etapa, Wittstock cree que tales "marcos" con motivos de almacenamiento de carga molecular podrían convertirse en un nuevo elemento de diseño en catalizadores moleculares complejos para reacciones de múltiples electrones.