Un diagrama que ilustra la acetilación de la enzima helicasa Pif1 Crédito:Matthew Bochman y Lata Balakrishnan, Universidad de Indiana Bloomington / IUPUI
Un nuevo estudio dirigido por científicos de la IUPUI y la Universidad de Indiana en Bloomington es el primero en describir un mecanismo bioquímico que aumenta la actividad de una molécula cuya presencia se observa en muchos tipos de cáncer.
La molécula, una enzima llamada Pif1helicasa, juega un papel en muchos procesos celulares importantes en el cuerpo. La regulación estricta de esta proteína es vital para la estabilidad del genoma porque muy poca o demasiada actividad puede influir en el envejecimiento y las enfermedades relacionadas con la edad. principalmente cáncer. Una terapia común contra el cáncer, Inhibidores de HDAC, también puede desencadenar un pico en esta enzima.
"En la actualidad, le estamos dando a las personas medicamentos que aumentan la actividad de Pif sin saber completamente cómo afecta a otras partes de la célula que juegan un papel en la estabilidad del genoma, "dijo Lata Balakrishnan, profesor asociado de biología en la Facultad de Ciencias de la IUPUI, quien es coautor principal del estudio.
"Los inhibidores de HDAC regulan positivamente ciertos genes supresores de tumores, y, por lo tanto, se utilizan en terapias combinadas para tratar cánceres específicos, pero cuando se trata de su impacto en otras partes de la célula, básicamente estamos operando en la oscuridad ".
El otro autor principal del estudio es Matthew Bochman, profesor asociado en el Departamento de Bioquímica Molecular y Celular de la Facultad de Artes y Ciencias de IU Bloomington. Otros coautores son Christopher Sausen y Onyekachi E. Ononye, Doctor. estudiantes en los laboratorios de Bochman y Balakrishnan, respectivamente, en el momento del estudio.
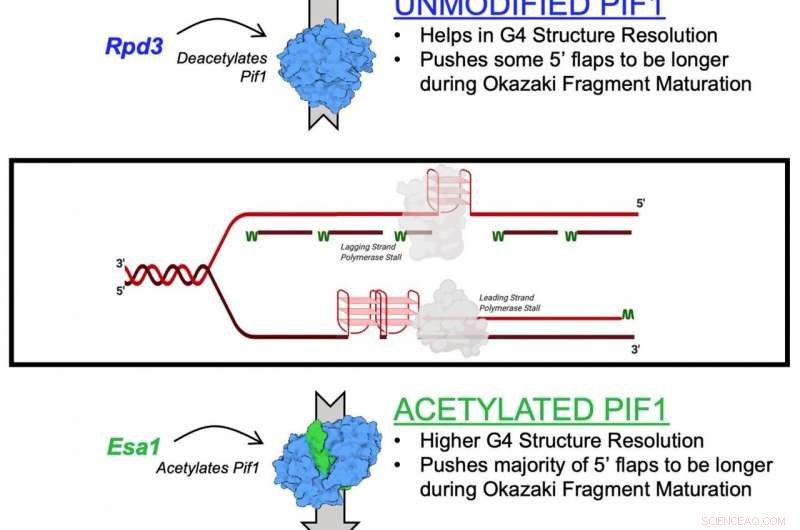
El mecanismo descrito en el estudio es el efecto de la acetilación de lisina sobre Pif1. La acetilación de lisina ocurre cuando una pequeña molécula llamada grupo acetilo se une a la lisina, un aminoácido que se usa para construir proteínas comunes en el cuerpo. Esta acción transforma la lisina de una molécula con carga positiva en una molécula con carga neutra. Esta neutralización puede afectar la función de las proteínas, estabilidad proteica e interacción proteína-proteína en las células, entre otras cosas.
Las helicasas se conocen como las "cremalleras" genéticas de las células porque separan el ADN con el propósito de la replicación y reparación genética. También ayudan a mantener los telómeros, la estructura al final de los cromosomas que se acortan a medida que las personas envejecen.
En el nuevo estudio, los investigadores identificaron la acetilación de lisina en la helicasa Pif1 y mostraron que la adición del grupo acetilo aumenta la actividad de la proteína, así como su función de "descompresión". También encontraron que la acetilación de lisina cambia la forma o "conformación" de la proteína Pif1. Creen que este cambio de forma aumenta la cantidad de helicasa Pif1.
"La interacción dinámica de la adición y eliminación del grupo acetilo en la lisina regula una amplia variedad de proteínas dentro de la célula, "Balakrishnan dijo." Las perturbaciones a este proceso pueden desempeñar un papel en el cáncer, envejecimiento, respuestas inflamatorias e incluso comportamientos relacionados con la adicción ".
"Como una clase, Las helicasas están involucradas en muchos procesos necesarios para la integridad del genoma, ", Agregó Bochman." Cualquier falla significativa en estos procesos es generalmente cancerígena ".
Los detalles precisos de la acetilación de lisina en Pif1, Su efecto de la forma de la enzima y el impacto resultante en la actividad de la helicasa tomó casi cinco años para ser observado e informado. El estudio, llevado a cabo en paralelo en dos campus de IU, fue posible gracias a la experiencia complementaria de los científicos principales. Como bioquímico que ha estudiado previamente la acetilación de lisina en otras proteínas, Balakrishnan pudo aislar Pif1 in vitro para observar su respuesta a reacciones químicas en un tubo de ensayo. A diferencia de, como genetista que trabaja en levaduras como organismo modelo para estudiar Pif1, Bochman pudo modificar las células in vivo para observar las reacciones que se desarrollan en un organismo vivo.
"La capacidad de observar estas reacciones en una célula viva suele ser más relevante, pero también es mucho más desordenado, ", Dijo Balakrishnan." Nuestros experimentos se informaban constantemente unos a otros sobre a dónde ir a continuación ".
Mirando hacia el futuro, Bochman dijo que el conocimiento complejo de los procesos celulares, como la acetilación de lisina, desempeñará un papel cada vez más importante en la terapia personalizada.
"Si secuencia el tumor de un paciente, puede ajustar los medicamentos para que se dirijan a enzimas muy específicas, ", dijo." En lugar de un fármaco que afecta ampliamente a toda la célula, será posible adoptar un enfoque específico que reduzca los posibles efectos secundarios. Este nivel de personalización es realmente el futuro de la biología y la medicina del cáncer ".