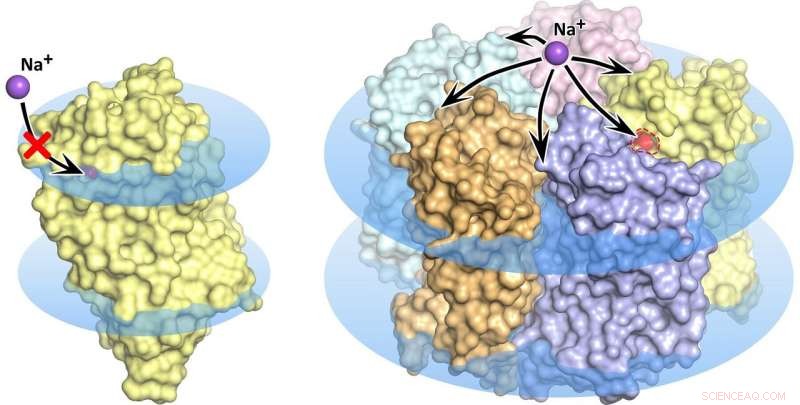
Monómero de rodopsina KR2 (izquierda) y pentámero (derecha) en la membrana celular, se muestran como discos azules. En el estado de monómero, el transporte de sodio está bloqueado, el poro naranja no permite la absorción de iones en la proteína. Crédito:Kirill Kovalev et al./ Avances de la ciencia
Un equipo de biofísicos de Rusia, Alemania, y Francia, con investigadores del Instituto de Física y Tecnología de Moscú, ha descubierto y estudiado la estructura de la rodopsina KR2 en condiciones fisiológicas. Este trabajo pionero abre el camino para un futuro avance en optogenética, un área de biomedicina de gran relevancia con aplicaciones en el tratamiento de enfermedades neurológicas y más. El descubrimiento fundamental conducirá a un nuevo instrumento para la terapia eficaz de la depresión, desórdenes de ansiedad, epilepsia, y enfermedad de Parkinson. El documento que informa sobre el estudio se publicó en Avances de la ciencia .
La optogenética es un área completamente nueva de biofísica y técnicas de exploración de biomedicina para controlar las células nerviosas y musculares en un organismo vivo a través de señales de luz. No hace mucho la revista de investigación líder Ciencias aclamó a la optogenética como el "avance de la década". Los métodos optogenéticos ya permiten una recuperación parcial de la visión perdida, audiencia, y control muscular afectado por una enfermedad neurológica. En tono rimbombante, estas técnicas permiten a los investigadores estudiar las redes neuronales en detalle. Esto no se refiere a las redes de computadoras, sino a las que se encuentran en el cerebro humano y son responsables de nuestras emociones. Toma de decisiones, y otros procesos fundamentales.
Muchos años atrás, Los investigadores descubrieron un nuevo tipo de transportador de iones, la rodopsina KR2, en la membrana celular de la bacteria marina Krokinobacter eikastus. La proteína recién encontrada es sensible a la luz, haciéndolo útil para la optogenética. Impulsado por la luz tales proteínas pueden facilitar la translocación de partículas cargadas como iones a través de la membrana celular. Al introducir estos transportadores en la célula, Luego, los investigadores pueden usar pulsos de luz para manipular el potencial de la membrana celular neuronal, controlando su actividad. Se demostró que KR2 transporta selectivamente un tipo particular de partículas, iones de sodio, fuera de la célula. En lugar de permitir el paso de estos iones en ambas direcciones, la proteína realiza un transporte activo, sirviendo como una "bomba". Las formas mutantes de KR2 también mostraron actividad de bombeo de potasio. Al implantar estas bombas en la membrana celular, En teoría, podría controlarse todo el alcance de la actividad neuronal.
La ola de investigación que siguió al descubrimiento de la nueva bomba molecular enfrentó algunas propiedades bastante misteriosas de la rodopsina. Varios grupos de investigación descubrieron y describieron un total de cinco estructuras diferentes de la proteína prometedora. Notablemente, en algunas de estas estructuras, cinco moléculas de KR2 forman un pentámero estable, mientras que en otros solo está presente el monómero proteico (figura 1).
"Entonces la pregunta dramática fue:¿Cuál de estas estructuras debería considerarse la correcta?" dijo el estudiante de doctorado del MIPT Kirill Kovalev, un autor principal del estudio. "De hecho, las estructuras resultaron ser bastante similares, pero el diablo está en los detalles que determinan las posibles aplicaciones de la proteína en la ciencia y la práctica clínica ".
Dirigido por biofísicos del MIPT, el equipo encontró lo que da lugar a la confusa variedad de estructuras de proteínas. Resultó que los grupos de investigación que estudiaban KR2 habían cristalizado la proteína en diferentes condiciones. La proteína única es producida originalmente por una bacteria del océano nativa de un entorno muy especial. Vive en aguas con una salinidad específica, acidez, y concentración de iones de hidrógeno (pH). Estas condiciones son un requisito previo para que la proteína haga lo que los investigadores esperan que haga, es decir, bombear iones de sodio, mientras que también forma pentámeros en la membrana celular. Las numerosas estructuras "falsas" de la proteína resultaron ser artefactos de cristalización o solo corresponden a las condiciones que virtualmente inhabilitan la actividad de bombeo de sodio de KR2. lo que lo hace muy atractivo para la comunidad global de optogenética.
"Por primera vez, hemos simulado las condiciones fisiológicas para la existencia y el funcionamiento de KR2. Como resultado, obtuvimos la estructura 'correcta' de la nueva proteína, que corresponde a su estado natal. Demostramos que la unidad funcional de la proteína es un pentámero, "explicó Valentin Gordeliy, del Instituto de Biología Estructural en Grenoble." Además de eso, encontramos una explicación para las contradicciones entre los estudios estructurales previos de la proteína ".
La rodopsina KR2 es revolucionaria para la optogenética, y conocer su correcta estructura en condiciones fisiológicas es fundamental tanto para comprender los mecanismos detrás de su funcionamiento como para explorar el sistema nervioso modelando nuevas herramientas optogenéticas y aplicándolas en la práctica médica.