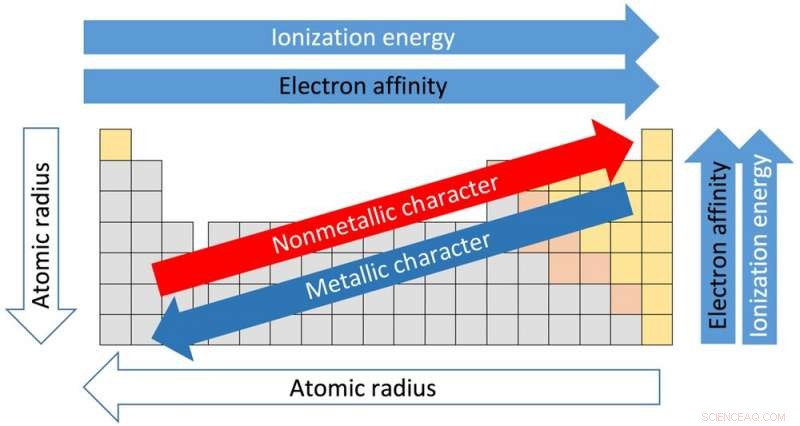
Tendencias de la tabla periódica. Crédito:Sandbh / Wikipedia, CC BY-SA
Se supo que un vagón de ferrocarril, cargado de sodio puro, acababa de descarrilar y estaba derramando su contenido. Un reportero de televisión me llamó para explicarme por qué no se permitía a los bomberos usar agua en las llamas que salían del auto destrozado. Mientras estaba en el aire, agregué un poco de sodio a un poco de agua en una placa de Petri y observamos la reacción viciosa. Para un efecto más dramático, También puse un poco de potasio en agua y asombré a todos con las explosivas llamas azuladas.
Porque los metales del Grupo I, también conocido como metales alcalinos, son muy reactivos, como el sodio del vagón o el potasio, no se encuentran en la naturaleza en forma pura, sino solo como sales. No solo son muy reactivos, son suaves y brillantes, se pueden cortar fácilmente incluso con un cuchillo desafilado y son los elementos más metálicos de todos los conocidos.
Soy un químico que pasó su carrera construyendo nuevas moléculas, a veces usando elementos del Grupo I. Al estudiar el comportamiento y las tendencias de los elementos del Grupo I, podemos vislumbrar cómo está organizada la tabla periódica y cómo interpretarla.
Los basicos
La disposición de la tabla periódica y las propiedades de cada elemento en ella se basan en el número atómico y la disposición de los electrones que orbitan alrededor del núcleo. El número atómico describe la cantidad de protones en el núcleo del elemento. El número atómico del hidrógeno es 1, el helio es 2, el litio es 3 y así sucesivamente.
Cada una de las 18 columnas de la tabla se denomina grupo o familia. Los elementos del mismo grupo comparten propiedades similares. Y las propiedades se pueden asumir en función de la ubicación dentro del grupo. Pasando de la parte superior del Grupo I a la parte inferior, por ejemplo, los radios atómicos, la distancia desde el núcleo a los electrones externos, aumenta. Pero la cantidad de energía necesaria para arrancar un electrón externo disminuye de arriba hacia abajo porque los electrones están más lejos del núcleo y no se mantienen tan apretados.
Esto es importante porque la forma en que los elementos interactúan y reaccionan entre sí depende de su capacidad para perder y ganar electrones para producir nuevos compuestos.
Las filas horizontales de la tabla se denominan puntos. Pasando del lado izquierdo del período al derecho, el radio atómico se vuelve más pequeño porque cada elemento tiene un protón adicional y un electrón adicional. Más protones significa que los electrones son atraídos con más fuerza hacia el núcleo. Por la misma razón, la electronegatividad, el grado en que un elemento tiende a ganar electrones, aumenta de izquierda a derecha.
La fuerza necesaria para eliminar el electrón más externo, conocido como potencial de ionización, también aumenta desde el lado izquierdo de la tabla, que tiene elementos de carácter metálico, al lado derecho, que son no metales.
La electronegatividad disminuye desde la parte superior de la columna hacia la parte inferior. El punto de fusión de los elementos dentro de un grupo también disminuye desde la parte superior a la inferior de un grupo.
Aplicar los conceptos básicos a los elementos del Grupo I
Como su nombre lo indica, Los elementos del grupo I ocupan la primera columna de la tabla periódica. Cada elemento inicia un nuevo período. El litio está en la parte superior del grupo y le sigue el sodio, N / A; potasio, K; rubidio, Rb; cesio, Cs y termina con el francio radiactivo, P. Debido a que es altamente radiactivo, prácticamente no se realiza química con este elemento.
Debido a que cada elemento de esta columna tiene un solo electrón externo en una nueva capa, los volúmenes de estos elementos son grandes y aumentan drásticamente al pasar de la parte superior a la inferior del grupo.
De todos los elementos del Grupo I, el cesio tiene los volúmenes más grandes porque el electrón más externo está suelto.
A pesar de estas tendencias, las propiedades de los elementos del Grupo I son más similares entre sí que las de cualquier otro grupo.
Metales alcalinos a través de la historia
Usando las propiedades químicas como guía, El químico ruso Dimitri Mendeleev ordenó correctamente los primeros elementos del Grupo I en su tabla periódica de 1869. Se llama periódico porque cada octavo elemento repite las propiedades del que está arriba en la tabla. Después de organizar todos los elementos conocidos en ese momento, Mendeleev dio el paso audaz de dejar espacios en blanco donde su extrapolación de propiedades químicas mostraba que un elemento debería existir. El descubrimiento posterior de estos nuevos elementos demostró que su predicción era correcta.
Algunos metales alcalinos se conocen y se les da un buen uso mucho antes de que Mendeleev creara la tabla periódica. Por ejemplo, el Antiguo Testamento menciona la sal, una combinación del sodio de metal alcalino con cloro, 31 veces. El Nuevo Testamento se refiere a él 10 veces y llama al carbonato de sodio "neter" y al nitrato de potasio "salitre".
La gente sabe desde la antigüedad que las cenizas de madera producen una sal de potasio que, cuando se combina con grasa animal, producirá jabón. Samuel Hopkins obtuvo la primera patente estadounidense el 31 de julio, 1790, para el jabón en virtud del nuevo estatuto de patentes que acaba de promulgar el presidente George Washington unos meses antes.
La industria pirotécnica adora estos elementos del Grupo I por sus colores vibrantes y su naturaleza explosiva. La quema de litio produce un vivo color rojo carmesí; sodio uno amarillo; lila de potasio; rojo rubidio; y violeta de cesio. Estos colores se producen cuando los electrones saltan de su entorno doméstico, orbitan alrededor del núcleo y regresan.
El reloj atómico de cesio, el reloj más preciso jamás desarrollado, funciona midiendo la frecuencia de los electrones de cesio que saltan de un estado a otro de energía. Los relojes basados en el salto de electrones proporcionan una forma extremadamente precisa de contar segundos.
Otras aplicaciones incluyen lámparas de vapor de sodio y baterías de litio.
En mi propia investigación he utilizado metales del Grupo I como herramientas para realizar otras químicas. Una vez necesité alcohol absolutamente seco, y el más seco que pude comprar todavía contenía pequeños rastros de agua. La única forma de deshacerse del último remanente de agua era tratando el alcohol que contiene agua con sodio, una forma bastante dramática de eliminar el agua.
Los elementos alcalinos no solo ocupan la primera columna de la tabla periódica, pero también muestran la mayor reactividad de todos los grupos en toda la tabla y tienen las tendencias más dramáticas en volumen y potencial de ionización, manteniendo una gran similitud entre ellos.
Este artículo se ha vuelto a publicar de The Conversation con una licencia de Creative Commons. Lea el artículo original. 