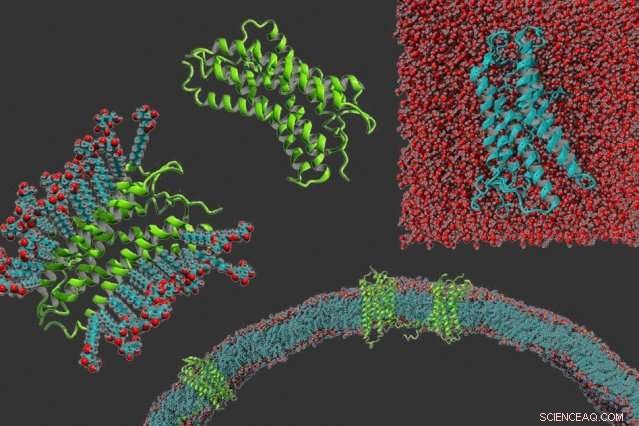
En el sentido de las agujas del reloj desde la izquierda:un receptor acoplado a proteína G en detergente, la proteína por sí sola, un receptor acoplado a proteína g que se ha hecho soluble en agua, y receptores acoplados a proteína g incrustados en una membrana. Crédito:Michael Skuhersky
Aproximadamente el 30 por ciento de las proteínas codificadas por el genoma humano son proteínas de membrana, proteínas que atraviesan la membrana celular para facilitar la comunicación entre las células y su entorno. Estas moléculas son fundamentales para el aprendizaje, viendo, y detectar olores, entre muchas otras funciones.
A pesar de la prevalencia de estas proteínas, Los científicos han tenido dificultades para estudiar sus estructuras y funciones porque las porciones unidas a la membrana son muy hidrófobas, por lo que no se pueden disolver en agua. Esto hace que sea mucho más difícil realizar análisis estructurales, como la cristalografía de rayos X.
En un avance que podría facilitar la realización de este tipo de estudios estructurales, Los investigadores del MIT han desarrollado una forma de hacer que estas proteínas sean solubles en agua intercambiando algunos de sus aminoácidos hidrofóbicos por hidrofílicos. La técnica se basa en un código mucho más simple que los métodos desarrollados anteriormente para hacer que estas proteínas sean solubles. que se basan en algoritmos informáticos que deben adaptarse a cada proteína caso por caso.
"Si no hay una regla a seguir, es difícil para la gente entender cómo hacerlo, "dice Shuguang Zhang, científico investigador principal en el Centro de bits y átomos del MIT Media Lab. "La herramienta tiene que ser simple, algo que cualquiera pueda usar, no una simulación por computadora sofisticada que solo unas pocas personas saben usar ".
Zhang es el autor principal del estudio, que aparece en el procedimientos de la Academia Nacional de Ciencias la semana del 27 de agosto. Otros autores del MIT son el ex profesor visitante Fei Tao, postdoctorado Rui Qing, ex profesor invitado Hongzhi Tang, estudiante de posgrado Michael Skuhersky, ex estudiante Karolina Corin '03, SM '05, Doctor. '11, ex postdoctorado Lotta Tegler, estudiante de posgrado Asmamaw Wassie, y el ex estudiante de pregrado Brook Wassie '14.
Un código simple
De los aproximadamente 8, 000 proteínas de membrana conocidas que se encuentran en células humanas, Los científicos han descubierto estructuras para aproximadamente 50. En general, se considera que es muy difícil trabajar con ellas porque una vez que se extraen de la membrana celular, solo mantienen su estructura si están suspendidos en un detergente, que imita el entorno hidrofóbico de la membrana celular. Estos detergentes son caros, y no existe un detergente universal que funcione para todas las proteínas de membrana.
Zhang comenzó a trabajar en una nueva forma de abordar este problema en 2010, inspirado por el difunto Alexander Rich, profesor de biología del MIT. Rich planteó la cuestión de si las estructuras proteicas llamadas hélices alfa, que constituyen la mayor parte de la porción de proteínas incrustadas en la membrana, podría cambiarse de hidrófobo a hidrófilo. Zhang inmediatamente comenzó a idear posibles soluciones. pero el problema resultó difícil. Durante los últimos ocho años, Ha tenido varios estudiantes e investigadores visitantes que lo ayudaron a trabajar en su idea, más recientemente Qing, que logró el éxito.
La idea clave que permitió a Zhang desarrollar el código es el hecho de que un puñado de aminoácidos hidrofóbicos tienen estructuras muy similares a algunos aminoácidos hidrofílicos. Estas similitudes permitieron a Zhang idear un código en el que la leucina se convierte en glutamina, isoleucina y valina se convierten en treonina, y la fenilalanina se convierte en tirosina.
Otro factor importante es que ninguno de estos aminoácidos está cargado, por lo que intercambiarlos parece tener un efecto mínimo en la estructura general de la proteína. De hecho, isoleucina y treonina son tan similares que los ribosomas, las estructuras celulares que ensamblan proteínas, ocasionalmente inserte el incorrecto, aproximadamente una de cada 200 a 400 apariciones.

El postdoctorado Rui Qing y el científico investigador principal Shuguang Zhang lideraron el esfuerzo para encontrar una manera simple de hacer que las proteínas unidas a la membrana sean solubles en agua. Crédito:Jun Ni
Los investigadores llaman a su código el código QTY, después de las tres letras que representan la glutamina, treonina, y tirosina, respectivamente.
En sus primeros esfuerzos por implementar este código, los investigadores sustituyeron solo una pequeña fracción de los aminoácidos hidrofóbicos incrustados en la membrana, pero las proteínas resultantes todavía necesitaban algo de detergente para disolverse. Aumentaron la tasa de reemplazo a aproximadamente el 50 por ciento, pero las proteínas todavía no eran completamente solubles en agua, por lo que reemplazaron todas las instancias de glutamina, isoleucina, valina, y fenilalanina incrustada en las membranas. Esta vez, lograron el éxito.
"Es solo cuando reemplazamos todos los residuos hidrofóbicos en las regiones transmembrana que podemos obtener proteínas que son estables y completamente libres de detergente en un sistema acuoso". "Dice Qing.
Similitudes estructurales
En este estudio, los investigadores demostraron su técnica en cuatro proteínas que pertenecen a una clase de proteínas conocidas como receptores acoplados a proteínas G. Estas proteínas ayudan a las células a reconocer moléculas, como las hormonas, o moléculas inmunes, llamadas quimiocinas, y desencadenar una respuesta adecuada dentro de la célula.
Joel Sussman, profesor de biología estructural en el Instituto de Ciencias Weizmann, describió el nuevo método como "increíblemente simple y elegante".
"Aunque varios científicos han estado tratando de encontrar una manera de 'solubilizar' los receptores acoplados a la proteína G y otras proteínas integrales de la membrana, Hasta ahora, sus métodos no han sido de uso generalizado y, a menudo, implicaban métodos computacionales muy complejos que no serían de aplicación generalizada. "dice Sussman, que no participó en la investigación.
Los investigadores todavía están trabajando para obtener las estructuras precisas de estas proteínas mediante cristalografía de rayos X o resonancia magnética nuclear (RMN). pero realizaron algunos experimentos que sugieren que las estructuras son similares. En uno, demostraron que las proteínas solubles en agua se desnaturalizan casi a la misma temperatura que las versiones originales de las proteínas. También demostraron que las proteínas modificadas se unen a las mismas moléculas diana a las que se unen las proteínas originales, aunque no con tanta fuerza.
Ser capaz de sintetizar versiones solubles en agua de estas proteínas podría permitir nuevas aplicaciones, como sensores que pueden detectar contaminantes ambientales, dicen los investigadores.
Otra posibilidad es diseñar versiones solubles en agua de las proteínas que se unen a moléculas que normalmente expresan las células cancerosas. que podría usarse para diagnosticar tumores o identificar células cancerosas metastásicas en muestras de sangre, Dice Zhang. Los investigadores también podrían crear moléculas solubles en agua en las que un receptor unido a la membrana al que normalmente se unen los virus se adhiera a parte de un anticuerpo. Si estas "terapias señuelo" se inyectaran en el cuerpo, los virus se unirían a los receptores y luego serían eliminados por el sistema inmunológico, que sería activado por la porción de anticuerpo.