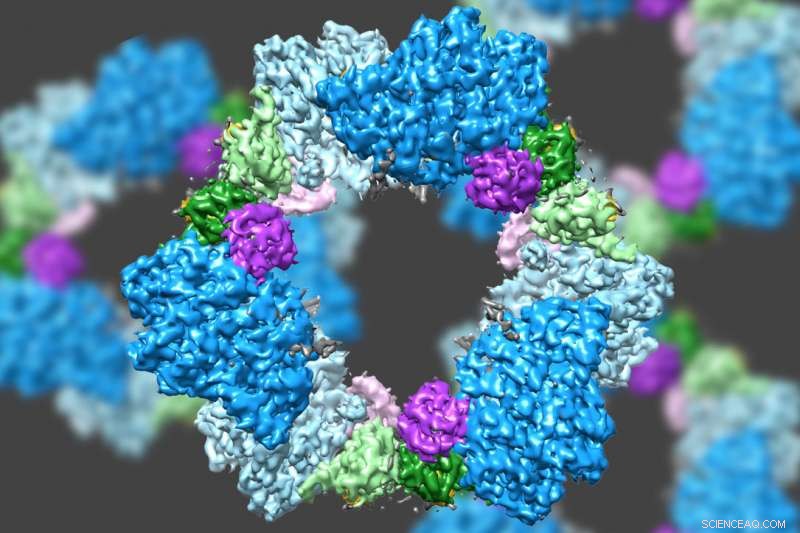
Usando un tipo de microscopía electrónica de última generación, Un equipo dirigido por el MIT ha descubierto la estructura de una enzima que es crucial para mantener un suministro adecuado de componentes básicos del ADN en las células humanas. Crédito:Instituto de Tecnología de Massachusetts
Usando un tipo de microscopía electrónica de última generación, Un equipo dirigido por el MIT ha descubierto la estructura de una enzima que es crucial para mantener un suministro adecuado de componentes básicos del ADN en las células humanas.
Su nueva estructura también revela el mecanismo probable de cómo las células regulan la enzima, conocida como ribonucleótido reductasa (RNR). Significativamente, el mecanismo parece diferir del de la versión bacteriana de la enzima, sugiriendo que podría ser posible diseñar antibióticos que bloqueen selectivamente la enzima bacteriana.
"La gente ha estado tratando de averiguar si hay algo lo suficientemente diferente como para inhibir las enzimas bacterianas y no la versión humana". "dice Catherine Drennan, profesor de química y biología del MIT e investigador del Instituto Médico Howard Hughes. "Al considerar estas enzimas clave y descubrir cuáles son las diferencias y similitudes, podemos ver si hay algo en la enzima bacteriana que se pueda atacar con fármacos de molécula pequeña ".
Drennan es uno de los autores principales del estudio, que aparece en la edición del 20 de febrero de la revista eLife . JoAnne Stubbe, el profesor emérita de Química Novartis en el MIT, y Francisco Asturias, profesor asociado de bioquímica en la Facultad de Medicina de la Universidad de Colorado, también son autores senior. Los autores principales del artículo son el científico investigador del MIT Edward Brignole y el ex postdoctorado del Instituto de Investigación Scripps Kuang-Lei Tsai, quien ahora es profesor asistente en el Centro Médico de la Universidad de Texas en Houston.
Una enzima inusual
La enzima RNR, que se encuentra en todas las células vivas, convierte los ribonucleótidos (los componentes básicos del ARN) en desoxirribonucleótidos (los componentes básicos del ADN). Las células deben mantener una reserva suficiente de estos bloques de construcción, pero cuando acumulan demasiados, El RNR es desactivado por una molécula de desoxinucleótido conocida como dATP. Cuando se necesitan más desoxinucleótidos, una molécula relacionada llamada ATP se une a RNR y lo vuelve a activar.
Una característica inusual de RNR es que puede catalizar la producción de cuatro productos diferentes:las bases de nucleótidos a menudo abreviadas como A, GRAMO, C, y T. En 2016, Drennan descubrió que la enzima logra esto cambiando su forma en respuesta a moléculas reguladoras.
La mayor parte del trabajo anterior de los investigadores sobre la estructura RNR se ha centrado en la versión que se encuentra en E. coli . Para esos estudios, utilizaron cristalografía de rayos X, una técnica que puede revelar la estructura atómica y molecular de una proteína después de que ha sido cristalizada.
En el nuevo estudio, Drennan y sus colegas se propusieron examinar la versión humana de RNR. La estructura de esta proteína, que resultó ser muy diferente a la versión bacteriana, resultó difícil de alcanzar utilizando cristalografía de rayos X, que no funciona bien para las proteínas que no se cristalizan fácilmente. En lugar de, los investigadores recurrieron a una forma avanzada de microscopía conocida como microscopía crioelectrónica (crio-EM).
Hasta hace poco, cryo-EM generalmente ofrecía una resolución de aproximadamente 10 a 20 angstroms, lo que podría revelar la forma general de una proteína, pero ningún detalle sobre la posición y la forma de unidades estructurales más pequeñas dentro de ella. Sin embargo, En los años pasados, Los avances tecnológicos han provocado una explosión en el número de estructuras que alcanzan resoluciones de aproximadamente 3 angstroms. Eso es lo suficientemente alto como para rastrear cadenas de proteínas individuales dentro de la molécula más grande, así como estructuras internas como hélices e incluso cadenas laterales de aminoácidos.
Los científicos ya sabían que RNR consta de dos subunidades de proteínas conocidas como alfa y beta. Usando cryo-EM, El equipo del MIT descubrió que la versión humana de la enzima forma un anillo formado por seis de las subunidades alfa. Cuando ATP, que activa RNR, está unido a la enzima, el anillo es inestable y se puede abrir fácilmente, permitiendo que la subunidad beta ingrese al anillo. Esta unión de alfa y beta permite que el sitio activo de la enzima, ubicado en la subunidad beta, para realizar las reacciones químicas necesarias para producir desoxinucleótidos.
Sin embargo, cuando el inhibidor dATP está presente, el anillo se vuelve mucho más rígido y no permite que entre la subunidad beta. Esto evita que la enzima catalice la producción de desoxinucleótidos.
Diseñar drogas
Varios medicamentos contra el cáncer actualmente en uso o en desarrollo se dirigen a la versión humana de RNR, interfiriendo con la capacidad de las células cancerosas para reproducirse al limitar su suministro de componentes básicos del ADN. El equipo del MIT ha encontrado evidencia de que al menos uno de estos medicamentos, difosfato de clofarabina, funciona induciendo la formación de anillos alfa rígidos de 6 unidades.
Este anillo de 6 unidades no se encuentra en la forma bacteriana de RNR, que en su lugar se ensambla en un anillo distinto que contiene cuatro subunidades alfa y cuatro subunidades beta. Esto significa que podría ser posible diseñar antibióticos que se dirijan a la versión bacteriana pero no a la versión humana. Drennan dice.
Ahora planea investigar las estructuras de otras moléculas de proteínas que son difíciles de estudiar con cristalografía de rayos X, incluyendo proteínas con racimos de azufre de hierro, que se encuentran en muchas vías metabólicas. El trabajo de microscopía en este estudio se realizó en el Instituto de Investigación Scripps, pero cuando se abre el nuevo edificio MIT.nano del MIT, albergará dos microscopios crio-EM que estarán disponibles para la comunidad del MIT, así como para otros usuarios potenciales en la industria y el mundo académico.
"Los avances tecnológicos que han permitido que cryo-EM alcance una resolución tan alta son realmente emocionantes, "Drennan dice." Realmente está comenzando a revolucionar el estudio de la biología ".