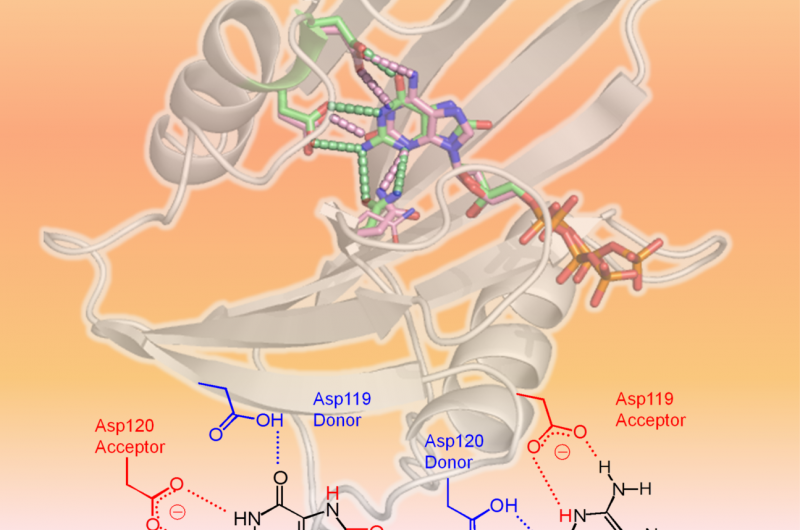
hMTH1 reconoce dos dNTP oxidados como se muestra en la estructura 3-D (área superior de la figura:hMTH1, cinta; dNTP dañados, palos). El factor determinante en la amplia especificidad del sustrato son los diferentes estados de protonación entre Asp-119 y Asp-120 (área inferior de la figura). Crédito:Profesora Yuriko Yamagata
La proteína homóloga 1 de MutT humana (hMTH1) actúa como la enzima principal para descomponer (hidrolizar) los desoxinucleósidos trifosfatos (dNTP) dañados (oxidados) los sustratos de la síntesis de ADN. Recientemente, hMTH1 ha llamado la atención como un objetivo popular para las nuevas terapias contra el cáncer porque no es esencial para las células normales. pero las células cancerosas lo requieren para evitar incorporar nucleótidos oxidados en el ADN, lo que daría lugar a la muerte de las células cancerosas. Ahora, Los inhibidores de hMTH1 se desarrollan como candidatos a fármacos contra el cáncer. Aunque algunos informes argumentan en contra de la utilidad de la inhibición de hMTH1, inhibidores altamente potentes y selectivos de hMTH1, que permitiría la introducción de nucleótidos oxidados en el ADN de las células cancerosas, se esperan para el tratamiento futuro del cáncer.
Las enzimas suelen ser muy particulares sobre el material que catalizan (sustrato). Algunos, sin embargo, puede catalizar más de un sustrato, y se sabe que hMTH1 hidroliza varios dNTP oxidados. Las razones detrás de la amplia especificidad del sustrato aún no se habían explorado cuando los investigadores de Japón comenzaron a considerar el tema.
Científicos de la Universidad de Kumamoto, los Institutos Nacionales de Ciencia y Tecnología Cuántica y Radiológica, y la Universidad de Kyushu realizaron análisis estructurales y cinéticos de hMTH1 para determinar los mecanismos detrás de su capacidad para hidrolizar varios dNTP mutagénicos oxidados, como 8-oxo-dGTP y 2-oxo-dATP, con similar eficiencia. Sus experimentos encontraron evidencia de que el estado de protonación entre los residuos de aspartato Asp-119 y Asp-120 era el factor determinante en la amplia especificidad de sustrato de hMTH1. En otras palabras, la adición o eliminación de uno o más protones en Asp-119 o Asp-120 es lo que hace que hMTH1 reconozca 8-oxo-dGTP o 2-oxo-dATP. Esto permite que hMTH1 hidrolice los dNTP mutagénicos oxidados antes de que se utilicen para la síntesis de ADN; El ADN que contiene nucleótidos oxidados provocaría la muerte de las células cancerosas.
"Encontramos que diferentes estados de protonación entre Asp-119 y Asp-120 es la señal para que hMTH1 hidrolice los nucleótidos dañados. Si esta acción de hMTH1 puede ser suprimida, las células cancerosas acumularían nucleótidos dañados y eventualmente sufrirían apoptosis, "dijo la profesora de la Universidad de Kumamoto, Yuriko Yamagata, líder del grupo de investigación. "La aclaración de este mecanismo debería ayudar en el desarrollo de medicamentos contra el cáncer dirigidos a hMTH1".