Las vacunas de ARN mensajero (ARNm) están revolucionando la terapia del cáncer. Pueden desarrollarse de manera flexible en un corto período de tiempo, lo que permite la expresión transitoria de múltiples antígenos para una inmunización segura y eficiente. Se está explorando en la clínica una diversidad de vacunas de ARNm para beneficiar a los pacientes con cáncer.
Sin embargo, la traducción de las vacunas de ARNm todavía se ve obstaculizada por barreras de administración de varias etapas antes de iniciar una inmunidad fuerte, incluida la eliminación rápida, la mala orientación a los órganos linfoides y las células dendríticas, la hidrólisis catalítica y la débil capacidad para atravesar las bicapas de fosfolípidos. Además, la vacunación con ARNm por sí sola apenas puede inducir respuestas inmunitarias fuertes en ausencia de adyuvantes. Sigue siendo un desafío mejorar la administración citosólica de ARNm y promover su eficacia de vacunación in vivo en combinación con adyuvantes.
En las últimas décadas, se ha informado que una gran cantidad de nanoportadores promueven la eficacia de la transfección de fármacos de ácido nucleico o administran fármacos a los ganglios linfáticos. Estos estudios proporcionan características valiosas que incluyen tamaño, carga superficial, modificación, capacidad de respuesta, componentes y citotoxicidad para lograr el objetivo de drenaje de los ganglios linfáticos o acceso citosólico.
Las técnicas de aprendizaje automático proporcionan herramientas poderosas para explorar las características fisicoquímicas y biológicas de estas nanopartículas y facilitan el diseño de nanoportadores con alta eficiencia. Por lo general, los modelos de aprendizaje automático se entrenaron, seleccionaron y optimizaron con conjuntos de datos masivos y de alta calidad a partir de cálculos y datos experimentales de alto rendimiento y, a su vez, guían el diseño racional, la detección y la optimización de los nanoportadores.
Al aprovechar las bases de datos de nanoportadores existentes, el aprendizaje automático puede proporcionar información sobre el diseño racional de nanovacunas con alta eficiencia.
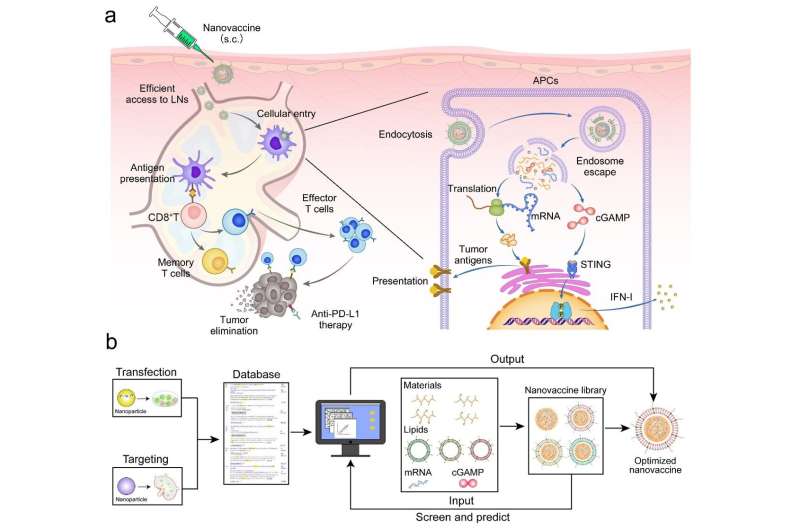
En un nuevo artículo de investigación publicado en el National Science Review , científicos de la Academia de Ciencias de China y la Universidad Jiao Tong de Shanghai utilizaron el aprendizaje automático para guiar el diseño racionalizado de nanovacunas de ARNm. Este estudio identificó los parámetros clave de las nanovacunas para la administración eficiente de ARNm y cGAMP basándose en un modelo de aprendizaje automático de la base de datos Nanocarrier.
Los nanocomplejos de ARNm/GAMPc basados en polietilenimina injertada con ácido fenilborónico se prepararon y se encapsularon adicionalmente con lípidos aniónicos para obtener la nanovacuna.
(1) La carga superficial negativa de la nanovacuna reduce la interacción con los glucosaminoglicanos cargados negativamente en la matriz y mejora la acumulación en los ganglios linfáticos.
(2) La nanovacuna, tras ser internalizada por las células presentadoras de antígenos (APC) de los ganglios linfáticos, promueve la liberación de ARNm y cGAMP desde los endosomas al citoplasma, lo que activa la vía STING e induce la presentación de antígenos tumorales.
(3) La activación de la vía STING promueve la liberación de IFN-I, que activa la respuesta inmune de las células T para matar las células tumorales e inhibir el crecimiento y la metástasis del tumor. En comparación con el ARNm solo, la estrategia terapéutica basada en esta nanovacuna demostró efectos antitumorales más fuertes en modelos de melanoma y cáncer colorrectal.
El artículo se publica en la revista National Science Review. .
Más información: Lei Zhou et al, Inmunización con ARNm potenciada por agonistas de STING mediante un diseño inteligente de nanovacunas para mejorar la inmunoterapia contra el cáncer, National Science Review (2023). DOI:10.1093/nsr/nwad214
Proporcionado por Science China Press