Recientemente, el equipo del académico Huang Wei, el profesor Li Lin y el profesor Hu Wen Bo de la Escuela de la Universidad Politécnica Northwestern desarrolló un agente fototérmico NIR-II ultraeficiente para el tratamiento fototérmico del osteosarcoma mediante láser de 1.064 nm.
El estudio, "La ingeniería de aceptores produce una descomposición no radiativa ultrarrápida en nanopartículas NIR-II Aza-BODIPY para un uso eficiente. Terapia fototérmica del osteosarcoma mediante apoptosis y piroptosis concurrentes", se publicó en Research .
El tratamiento del cáncer sigue siendo uno de los mayores desafíos que enfrenta la gente hoy en día, a pesar de que la tecnología médica es sustancialmente mejor. En los últimos años, el desarrollo de agentes fototérmicos (PAT) de infrarrojo cercano (NIR), que son fármacos moleculares dirigidos para la terapia fototérmica (PTT), ha surgido como un nuevo punto de investigación.
En comparación con otras bandas de luz, la luz NIR tiene una mejor capacidad de penetración biológica y puede usarse para PTT leve de tejido profundo cuando se combina con PAT apropiadas. La mayoría de los experimentos con modelos de ratones todavía se encuentran en la etapa de terapia tumoral subcutánea, que está limitada por la poca profundidad de penetración de la luz NIR-I y no puede eliminar el tejido tumoral profundo del cuerpo.
Sin embargo, la profundidad de penetración de la luz NIR-II aumenta y se espera que el PTT de tumores profundos alcance una aplicación clínica. En la actualidad, existen muchos estudios sobre los ACP y con frecuencia se desarrollan diversos materiales nuevos. Los factores que afectan la función de los PTA incluyen la longitud de onda de absorción, el tamaño y la modificación de la superficie.
Aunque los diferentes tipos de PTA muestran ventajas únicas, es necesario explorar un material fototérmico que integre muchas ventajas, como altas eficiencias de conversión fototérmica (PCE), una larga longitud de onda de absorción, una gran bioseguridad y una buena solubilidad en agua.
Los PTA de molécula pequeña con intensa absorción de NIR-II y PCE elevados son candidatos prometedores para el tratamiento de tumores profundos como el osteosarcoma. Hasta la fecha, el desarrollo de PTA NIR-II de molécula pequeña se ha basado en gran medida en la fabricación de estructuras donante-aceptor-donante (D–A–D/D') y se ha logrado un éxito limitado.
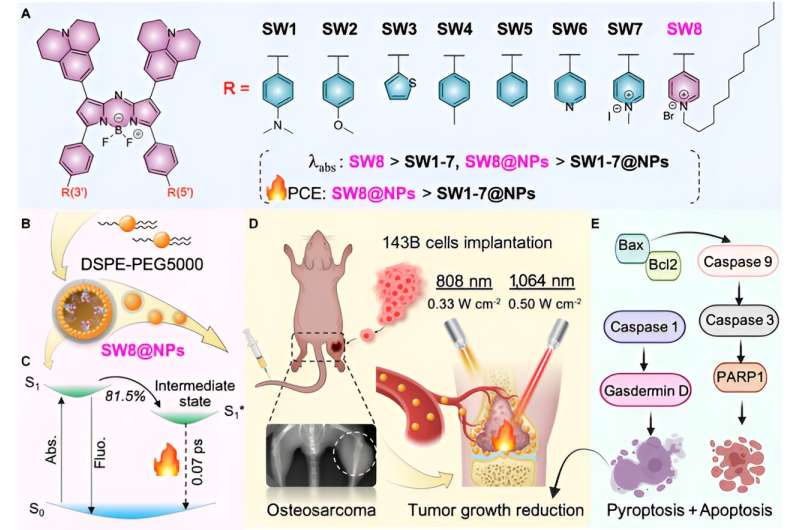
En este documento, a través de la ingeniería de aceptores, se desarrolló fácilmente un PTA (SW8) de aza-boro-dipirrometeno (aza-BODIPY) NIR-II estructurado por donante-aceptor-aceptor (D–A–A') para el sistema fototeranóstico mediado por láser de 1.064 nm. tratamiento del osteosarcoma.
El cambio de los grupos donantes a grupos aceptores produjo notables desplazamientos al rojo de los máximos de absorción de las regiones NIR-I (~808 nm) a las NIR-II (~1064 nm) para aza-BODIPY (SW1 a SW8). Además, SW8 se autoensambló en nanopartículas (SW8@NP) con una intensa absorción NIR-II y un PCE ultraalto (75 %, 1064 nm).
Este PCE ultraalto se originó principalmente a partir de una vía de desintegración no radiativa adicional, que mostró una tasa de desintegración 100 veces mayor en comparación con la mostrada por vías convencionales como la conversión interna y la relajación vibratoria. Finalmente, SW8@NPs realizó PTT NIR-II mediada por láser de 1064 nm de osteosarcoma altamente eficiente mediante apoptosis y piroptosis concurrentes.
Este trabajo no solo ilustra un enfoque remoto para el tratamiento de tumores profundos con un alto control espaciotemporal, sino que también proporciona una nueva estrategia para construir PTA NIR-II de molécula pequeña de alto rendimiento.
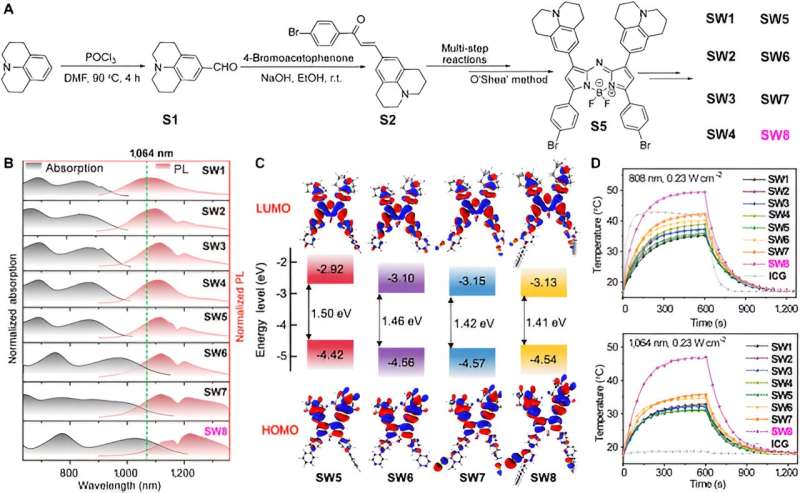
En primer lugar, los investigadores sintetizaron una serie de PTA orgánicos de molécula pequeña basados en aza-BODIPY. En particular, se produjeron desplazamientos al rojo notables para los espectros de absorción y PL de SW5 a SW6, donde el donante de benceno donador de electrones (D') se cambió al aceptor de piridina (A').
Un mayor aumento en la deficiencia de electrones de A' causó más longitudes de onda batocrómicas de SW6 a SW8, especialmente el desplazamiento hacia el rojo de la longitud de onda de absorción es obvio, mientras que la fracción donadora de electrones (de SW1 a SW5) no mostró un cambio de longitud de onda pronunciado. Además, la introducción de cadenas alquílicas mejoró la agregación J de las moléculas, que se manifiesta por un desplazamiento hacia el rojo de la longitud de onda de emisión de SW6 a SW8. Los cálculos de la teoría funcional de la densidad dependiente del tiempo (TD-DFT) revelaron una disminución gradual en la brecha de energía HOMO-LUMO de SW5 a SW8, consistente con los espectros desplazados al rojo.
En particular, los niveles de energía LUMO para SW5–8 se redujeron en orden, mientras que los niveles de energía HOMO se mantuvieron casi sin cambios. Este fenómeno indica que los segmentos aceptores en las posiciones 3 y 5 de aza-BODIPY redujeron significativamente las brechas de energía, ofreciendo un enfoque alternativo para construir nuevos materiales orgánicos NIR-II de molécula pequeña.
Luego, este artículo selecciona la longitud de onda de absorción/emisión SW8 más ventajosa para el autoensamblaje. SW8 se encapsuló en una matriz anfifílica para formar nanopartículas solubles en agua (SW8@NP). Se determinó que el PCE de SW8@NP bajo irradiación láser de 1.064 nm era tan alto como 75%, lo que es una mejora notable en comparación con el de SW1-7@NP.
Además, los estudios espectroscópicos ultrarrápidos atribuyeron este PCE ultraalto a un estado intermedio no radiativo. Este intermedio oscuro agotó hasta el 80% de la población excitada con una alta tasa de desintegración de 1,3 × 10 13 s -1 sobre canales de desintegración no radiativos convencionales, como la conversión interna, lo que da como resultado un PCE ultraalto.
Finalmente, para estudiar la biocompatibilidad de SW8@NP, la célula de osteosarcoma 143B se trató con SW8@NP. Los resultados mostraron que las SW8@NP podrían ser absorbidas celularmente de manera eficiente por las células 143B con baja toxicidad en la oscuridad y alta fototoxicidad. El nivel de apoptosis aumentó significativamente después de 808 nm y se tomaron 1.064 imágenes fototérmicas. Se utilizaron imágenes de rayos X para controlar el crecimiento del tumor ortotópico. Los tumores se irradiaron con láser durante 10 minutos y se repitieron cada dos días durante 12 días.
La curva de tendencia del volumen para el grupo "SW8@NPs +1.064 nm laser" demostró la erradicación completa del tumor durante los 12 días de seguimiento. Por el contrario, los otros cinco tratamientos no lograron suprimir el crecimiento del tumor, con un aumento promedio en el volumen del tumor de 4 a 5 veces la irradiación con láser nm. En comparación con el láser de 808 nm, el láser de 1064 nn puede penetrar tejido muscular de 15 mm de espesor y estimular eficazmente la producción de calor de SW8@NP. Estudios adicionales en ratones ortotópicos con tumores 143B mostraron que los SW8@NP tenían una alta acumulación y un fuerte efecto fototérmico en el sitio del tumor. Irradiación continua de regiones tumorales durante 10 minutos utilizando un 808 (0,33 W cm -2 ) o láser de 1.064 nm (0,5 W cm -2 ) se realizó 24 h después de la inyección de SW8@NPs.
Además, los ensayos histológicos e inmunohistoquímicos mostraron que la estructura tumoral en el grupo "SW8@NPs+1.064 nm" estaba gravemente dañada y las células parenquimatosas desaparecieron en grandes cantidades y aparecieron vacuolares, y los resultados de TUNEL mostraron que el nivel de apoptosis fue significativamente aumentó. Se utilizó transferencia Western para analizar proteínas asociadas a la apoptosis (Bax, Bcl2, Caspasa 9, Caspasa 3 y PARP1).
En el grupo "SW8@NPs+1.064 nm", el nivel general de fosforilación de la proteína apoptótica aumentó y la apoptosis se activó mediante irradiación. En conjunto, los resultados revelaron, por primera vez, que el PTT NIR-II mediado por SW8@NPs ejercía efectos antitumorales principalmente estimulando la apoptosis y la piroptosis concurrentes.
En este estudio, informaron sobre el diseño de una nueva PTA orgánica de molécula pequeña (SW8) y nanopartículas de autoaccesibilidad (SW8@NP) con un alto PCE (75%) en la ventana NIR-II (1064 nm). El análisis de la dinámica del estado excitado molecular mostró que este PCE ultraalto se originó principalmente a partir de una vía de desintegración no radiativa adicional.
Una serie de experimentos in vitro e in vivo demostraron por primera vez que el PTT NIR-II superior podría inducir eficazmente apoptosis y piroptosis concurrentes en tejidos de osteosarcoma. Los investigadores sugieren que el diseño de PTA orgánicos de molécula pequeña basados en principios racionales en la ventana NIR-II beneficiará las aplicaciones clínicas prácticas de activaciones y tratamientos fototérmicos en el futuro.
Más información: Zhenxiong Shi et al, Acceptor Engineering Produces Ultrafast Nonradiative Decay in NIR-II Aza-BODIPY Nanoparticles for Efficient Osteosarcoma Photothermal Therapy via Concurrente Apoptosis and Pyroptosis, Investigación (2023). DOI:10.34133/investigación.0169
Información de la revista: Investigación
Proporcionado por Investigación