Las jaulas de proteínas que se encuentran dentro de los microbios ayudan a su contenido a resistir el duro entorno intracelular, una observación que tiene muchas aplicaciones en bioingeniería. Los investigadores de Tokyo Tech han desarrollado recientemente un enfoque innovador de bioingeniería que utiliza bacterias genéticamente modificadas para incorporar jaulas de proteínas alrededor de cristales de proteínas. Este método de biosíntesis intracelular produce de manera eficiente complejos proteicos altamente personalizados, que podrían encontrar aplicaciones como catalizadores sólidos avanzados y nanomateriales funcionalizados.
En la naturaleza, las proteínas pueden ensamblarse para formar complejos organizados con innumerables formas y propósitos. Gracias al notable progreso de la bioingeniería en las últimas décadas, los científicos ahora pueden producir conjuntos de proteínas personalizados para aplicaciones especializadas. Por ejemplo, las jaulas de proteínas pueden confinar enzimas que actúan como catalizadores para una reacción química específica. De manera similar, los cristales de proteínas (estructuras compuestas de unidades repetidas de proteínas) pueden servir como andamios para sintetizar materiales sólidos con terminales funcionales expuestos.
Sin embargo, incorporar (o "encapsular") proteínas extrañas en la superficie de un cristal de proteína supone un desafío. Por lo tanto, ha sido difícil sintetizar cristales de proteínas que encapsulan conjuntos de proteínas extrañas. Hasta el momento, no existen métodos eficientes para lograr este objetivo y los tipos de cristales de proteínas producidos son limitados. Pero ¿y si la maquinaria celular bacteriana fuera la respuesta?
En un estudio reciente, un equipo de investigación del Instituto de Tecnología de Tokio, incluido el profesor Takafumi Ueno, informó sobre un nuevo método intracelular para encapsular jaulas de proteínas con diversas funciones en cristales de proteínas. Su artículo, publicado en Nano Letters , representa un avance sustancial en la ingeniería de cristales de proteínas.
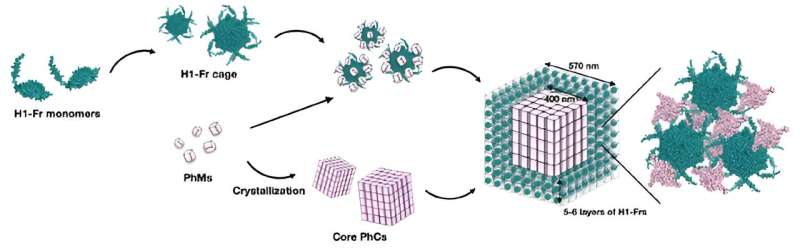
La estrategia del equipo consiste en modificar genéticamente la bacteria Escherichia coli para producir dos componentes básicos:monómero de poliedrina (PhM) y ferritina modificada (Fr). Por un lado, los PhM se combinan naturalmente dentro de las células para formar un cristal de proteína bien estudiado llamado cristal de poliedros (PhC). Por otro lado, se sabe que las unidades de 24 Fr se combinan para formar una jaula de proteínas estable.
"La ferritina se ha utilizado ampliamente como plantilla para la construcción de bionanomateriales modificando sus superficies internas y externas. Por lo tanto, si la formación de una jaula de Fr y su posterior inmovilización en PhC se puede realizar simultáneamente en una sola célula, las aplicaciones de Los cristales de proteínas dentro de las células se ampliarán como materiales biohíbridos", explica el profesor Ueno.
Para inmovilizar las jaulas de Fr en PhC, los investigadores modificaron el gen que codifica Fr para incluir una etiqueta α-hélice (H1) de PhM, creando así H1-Fr. El razonamiento detrás de este enfoque es que las hélices H1 presentes naturalmente en las moléculas PhM interactúan significativamente con las etiquetas en H1-Fr, actuando como "agentes de reclutamiento" que unen las proteínas extrañas al cristal.
Utilizando técnicas químicas, analíticas y de microscopía avanzadas, el equipo de investigación verificó la validez del enfoque propuesto. A través de varios experimentos, descubrieron que los cristales resultantes tenían una estructura de núcleo-capa, es decir, un núcleo cúbico de PhC de unos 400 nanómetros de ancho cubierto por cinco o seis capas de jaulas de H1-Fr.
Esta estrategia para la biosíntesis de cristales de proteínas funcionales es muy prometedora para aplicaciones en medicina, catálisis e ingeniería de biomateriales. "Las jaulas H1-Fr tienen el potencial de inmovilizar moléculas externas en su interior para su entrega molecular", afirma el profesor Ueno.
"Nuestros resultados indican que las estructuras núcleo-capa H1-Fr/PhC, que muestran jaulas H1-Fr en la superficie exterior del núcleo PhC, pueden controlarse individualmente a nivel nanoescalar. Acumulando diferentes moléculas funcionales en el núcleo PhC y H1 -En jaula, se pueden construir cristales jerárquicos controlados a nanoescala para aplicaciones biotecnológicas avanzadas."
Los trabajos futuros en este campo nos ayudarán a aprovechar el verdadero potencial de los conjuntos y cristales de proteínas de bioingeniería. Con un poco de suerte, estos esfuerzos allanarán el camino hacia un futuro más saludable y sostenible.
Más información: Thuc Toan Pham et al, Mostrando una jaula de proteínas en un cristal de proteínas mediante In-Cell Crystal Engineering, Nano Letters (2023). DOI:10.1021/acs.nanolett.3c02117
Proporcionado por el Instituto de Tecnología de Tokio