Todas las células secretan vesículas extracelulares a nanoescala de forma natural como partículas delimitadas por bicapa lipídica. Por tanto son biomarcadores válidos para identificar una variedad de enfermedades.
Es importante aislar eficazmente pequeñas vesículas extracelulares manteniendo el rendimiento y la pureza para explorar su potencial en aplicaciones de diagnóstico, pronóstico y terapéuticas.
Los métodos convencionales de aislamiento tienen desventajas, que incluyen baja pureza y rendimiento, procedimientos de extracción prolongados, equipos especializados y altos costos.
En un estudio publicado en Scientific Reports , Manju Sharma y un equipo de científicos en ingeniería biomédica de la Universidad de Cincinnati, Ohio, EE. UU., desarrollaron un nuevo dispositivo dielectroforético basado en un aislante para aislar rápidamente pequeñas vesículas extracelulares de biofluidos y medios de cultivo celular, basándose en sus propiedades dieléctricas.
Los científicos caracterizaron las pequeñas vesículas extracelulares aisladas de los biofluidos de pacientes con cáncer utilizando el instrumento y realizaron una caracterización triple con citometría de flujo convencional, citometría de flujo de imágenes avanzadas y secuenciación de microARN para obtener un alto rendimiento de vesículas extracelulares puras. La plataforma es eficaz para aislar rápidamente biomarcadores y mantener la integridad biomolecular de las vesículas.
Biológicamente, las pequeñas vesículas extracelulares son vasos biológicos encapsulados en membranas que se encuentran en biofluidos como sangre, orina, saliva, semen, leche materna y líquido cefalorraquídeo; liberado por las células al espacio extracelular.
Estas vesículas a nanoescala pueden transferir horizontalmente su carga biomolecular para funcionar como vectores de señalización intercelular. Estas vesículas extracelulares proporcionan un alto grado de sensibilidad y especificidad debido a su excelente estabilidad. Su detección precoz en biopsias líquidas puede mejorar la detección de cánceres, infecciones y enfermedades neurodegenerativas y metabólicas.
Sin embargo, el aislamiento de las vesículas es un desafío debido a su tamaño a nanoescala y sus propiedades fisicoquímicas. Los métodos de aislamiento generalmente dependen de las propiedades de las vesículas extracelulares y, si bien dichos dispositivos tienen atributos prometedores, su costo de fabricación, dilución de la muestra y susceptibilidad a la obstrucción son desafíos inherentes.
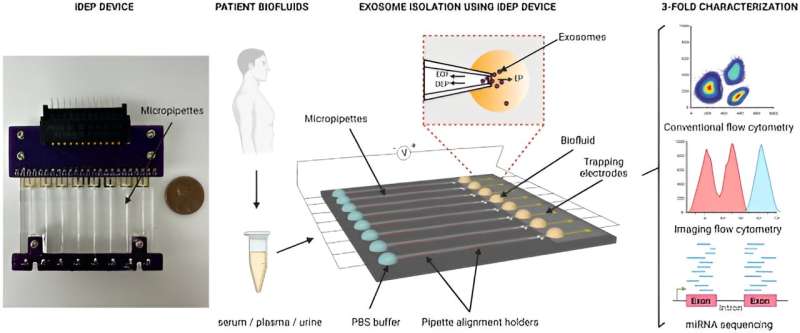
En respuesta, Sharma y sus colegas desarrollaron una clase de nuevo enfoque dielectroforético basado en aislantes con micropilares en canales de microfluidos para engullir rápidamente nanopartículas en función de su tamaño y propiedades dieléctricas únicas.
El dispositivo mantuvo una serie de micropipetas que son capaces de aislar nanopartículas de pequeños volúmenes de muestra aplicando un campo eléctrico significativamente bajo a lo largo de las pipetas. La arquitectura de la geometría de los poros permitió el aislamiento de vesículas extracelulares a partir de pequeños volúmenes de muestra de medios de cultivo celular condicionados y biofluidos de donantes sanos.
En este trabajo, Sharma y su equipo aislaron los biofluidos de pacientes con cáncer, que incluían suero, plasma y orina, seguido de una caracterización multiparamétrica mediante citometría de flujo y secuenciación de miARN de próxima generación.
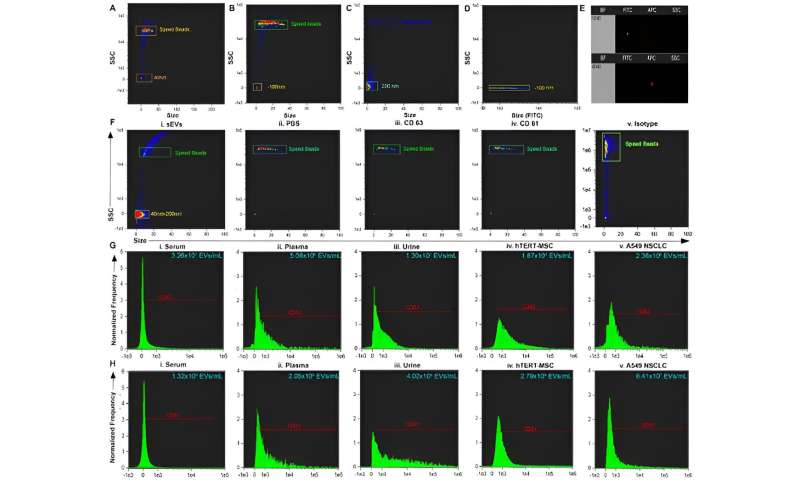
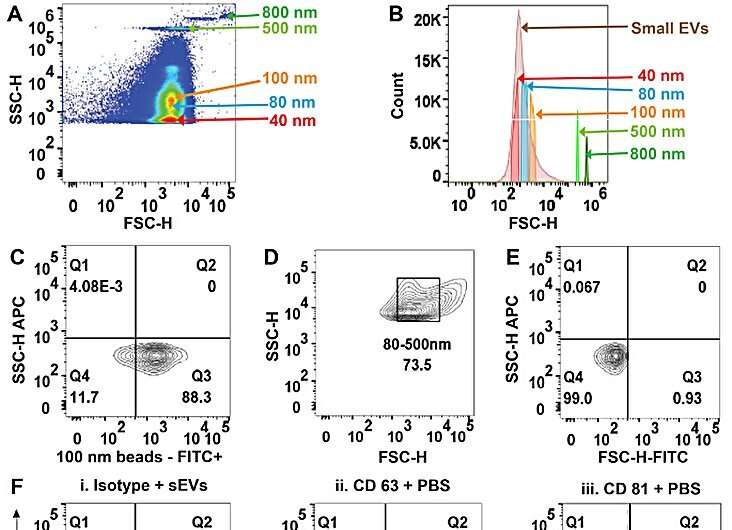
El equipo purificó pequeñas vesículas extracelulares de suero, plasma y orina en solución salina tamponada con fosfato mediante el método dielectroforético basado en aislantes. Sharma y sus colegas utilizaron microscopía electrónica de transmisión para confirmar la presencia de las vesículas y exploraron el análisis multiparamétrico de pequeñas vesículas extracelulares circulantes purificadas mediante citometría de flujo.
El equipo aisló las vesículas y las analizó, seguido de estudios de citometría de flujo convencional. Los investigadores demostraron además la capacidad y el uso del dispositivo caracterizando los aislamientos mediante el software ImageStream.
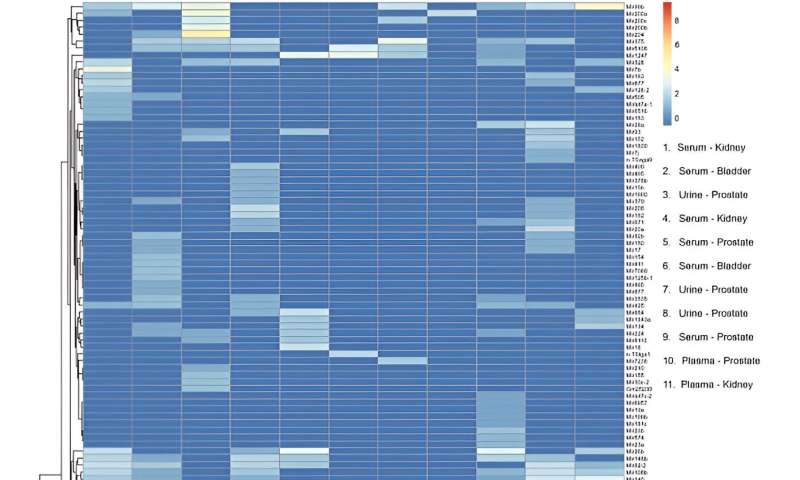
Después de la secuenciación de miARN, el equipo mapeó 137 transcripciones de miARN maduras distintas al genoma humano en muestras para incluir el dispositivo en los flujos de trabajo de análisis de biomarcadores de miARN. Realizaron perfiles transcriptómicos y realizaron análisis de componentes principales.
Perspectivas
De esta manera, Manju Sharma y sus colegas demostraron la capacidad y eficiencia de un dispositivo dielectroforético de bajo voltaje y sin etiquetas, basado en un aislante, para aislar pequeñas vesículas extracelulares del suero, plasma y orina de pacientes con cáncer mediante la detección de partículas submicrónicas, y caracterización multiparamétrica mediante el uso de citometría de flujo convencional y métodos avanzados de citometría de flujo.
Las concentraciones de ARN del trabajo fueron comparables a trabajos anteriores y afirmaron que el método de aislamiento es una alternativa viable a los ya establecidos en el laboratorio. Los métodos analíticos pueden ser útiles como plataformas de biopsia líquida para aislar pequeñas vesículas extracelulares y desarrollar plataformas de seguimiento y diagnóstico basadas en vesículas extracelulares.
Más información: Manju Sharma et al, Purificación rápida y caracterización multiparamétrica de pequeñas vesículas extracelulares circulantes utilizando un dispositivo de laboratorio en un chip sin etiquetas, Scientific Reports (2023). DOI:10.1038/s41598-023-45409-4
Información de la revista: Informes científicos
© 2023 Red Ciencia X